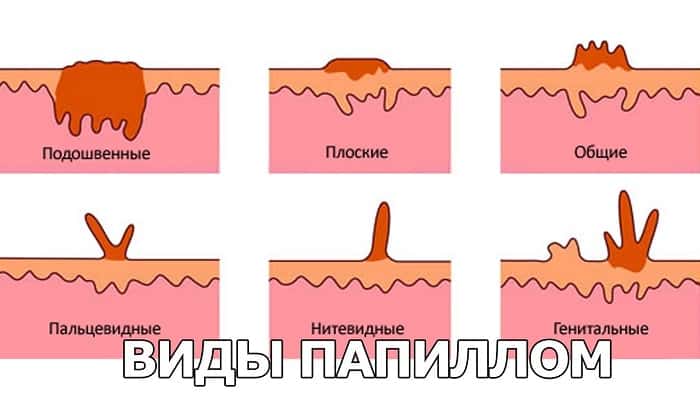
Впч и рак кишечника
HPV infection, anal intra-epithelial neoplasia (AIN) and anal cancer: current issues
Источник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3488563/
Папилломавирус человека (ВПЧ) хорошо известен как основной этиологический агент для аногенитального рака. В отличие от рака шейки матки, анальный рак является необычным, но в последние несколько десятилетий он неуклонно растет в обществе. Тем не менее, он подвергся экспоненциальному росту среди мужчин, имеющих половые контакты с мужчинами (МСМ) и групп ВИЧ +. ВИЧ + МСМ, в частности, имеют случаи анального рака примерно в три раза выше, чем у всех зарегистрированных в мире случаев рака шейки матки.
Поэтому традиционно отсутствовали данные исследований, посвященных гетеросексуальным мужчинам и женщинам, не связанным с ВИЧ +. Существует также меньше фактов, сообщающих о предполагаемом поражении предшественника анальному раку (AIN — анальная интраэпителиальная неоплазия) по сравнению с раком шейки матки и CIN (цервикальная интраэпителиальная неоплазия). В этом обзоре обобщаются имеющиеся биологические и эпидемиологические данные о ВПЧ в анальном очаге и патогенез AIN и анального рака среди групп традиционно не высокого риска.
Имеются убедительные доказательства того, что полноценный AIN является предшественником анального рака, а также некоторые данные о прогрессировании AIN для инвазивного рака.
Примерно 15 из 30-40 типов вируса папилломы человека (ВПЧ), заражающих слизистые оболочки аногенных (шейка матки, влагалища, вульвы, ануса и пениса), являются онкогенными вирусами, вызывая ~ 5,2% от общего числа случаев рака человека
[1]. Как и рак шейки матки, плоскоклеточный рак ануса (анального SCC), как полагают, предшествует спектр внутриэпителиальных изменений, анальная внутриэпителиальная неоплазия (AIN), различной цитологической и гистологической тяжести AIN 1 — мягкая, AIN 2 — умеренный, AIN 3 — тяжелый, похожий на цервикальную внутриэпителиальную неоплазию (CIN), которые соответствуют спектру CIN CIN 1, CIN 2/3
[2-4]. Успех существующих профилактических вакцин против ВПЧ L1 в профилактике полноценной дисплазии шейки матки (и, следовательно, конечного результата рака) поставил вопрос о том, будут ли эти вакцины успешными в предотвращении других случаев, связанных с ВПЧ, и будет ли последующее лицензирование вакцины для рака шейки матки заслуживает внимания.
В этом контексте мы обобщим имеющиеся данные, которые направлены на то, чтобы ответить на три вопроса, которые в настоящее время обсуждаются для анального рака и предраковых заболеваний.
1) Отсутствие данных об AIN и анальном раке из большей доли сообщества, то есть гетеросексуальных мужчин и женщин, не являющихся ВИЧ-положительными или не высокопоставленными, что означает, что большинство выводов, таким образом, экстраполируются из данных МСМ.
2) что AIN является предшественником, поражающим инвазивный анальный рак.
3) Скорость прогрессирования AIN 3 до инвазивного анального рака.
Anal SCC — это необычный рак, но заболеваемость во всем мире растет у мужчин и женщин
[3]. Женщины имеют более высокий уровень заболеваемости в возрастных группах старше 50 лет, но мужчины доминируют в возрасте 20-49 лет. У мужчин и женщин общие факторы риска — это восприимчивый анальный секс, пожизненное количество сексуальных партнеров, история генитальных бородавок и курение сигарет. Кроме того, у женщин дополнительные факторы риска — это история высокоинтегральной внутриэпителиальной неоплазии (VIN 3), цервикального интраэпителиального рака (CIN 3), рака вульвы или рака шейки матки
[4]. Иммуносупрессивные индивидуумы, такие как реципиенты твердых трансплантатов органов и ВИЧ-инфицированные пациенты, также более восприимчивы к раковым заболеваниям, связанным с ВПЧ
[5,6]. Большинство анальных ГТК являются следствием заражения половым или иным способом в анальной слизистой оболочке с онкогенными подтипами ВПЧ, преимущественно с ВПЧ 16
[7].
В Шотландии в период с 1975 по 2002 год частота анального ГТК удвоилась до 0,37 на 100 000 у мужчин и 0,55 у женщин
[8]. Данные Национального обзора сексуальных отношений и образа жизни (NATSAL) в 2000 году (цитируется в
[8]) показывает, что в Шотландии сообщалось, что распространенность анального полового акта у женщин (11,16%) была значительно выше, чем у мужчин (0,7%), что указывает на то, что это поведение может частично объяснить наблюдаемую разницу в распространенности анального рака между полами. Кроме того, анатомическая близость влагалищного интроита к анусу также облегчает несексуальную и автоматическую инокуляцию у женщин через вагинальные выделения, передачу цифровых или фомитных
[9,10]. Доля шотландских женщин, сообщивших о практике анального полового акта, значительно ниже, чем в аналогичных исследованиях в США, где была зарегистрирована распространенность 22-29%
[11,12]. Эти расхождения могут представлять собой поведенческие различия в поведении населения или, возможно, более вероятно, недостаточную отчетность. Даже анонимные исследования могут демонстрировать значительный уклон при представлении поведенческих аспектов, особенно при меньших исследованиях. Общий риск для анального ГТК связан с сексуальным поведением между или внутри пола, а не сексуальным предпочтением; увеличение заболеваемости было показано до появления эпидемии ВИЧ
[3]. Большинство исследований распространенности анальной инфекции HPV и AIN были в когорте МСМ, особенно ВИЧ-инфицированных МСМ, поскольку это группа с наивысшим риском
[13], но есть также некоторые данные от ВИЧ-инфицированных и ВИЧ-отрицательных женщин с высоким уровнем риска
[14]. Тем не менее, нехватка данных от гетеросексуальных мужских и не ВИЧ-инфицированных или не высокопоставленных женских популяций (крупнейших групп населения в целом, которые составляют значительное число больных раком анального рака) является проблемой при клиническом лечении эти пациенты, особенно в определении обоснования и осуществимости разработки программы скрининга. Тем не менее, вполне вероятно, что среди мужчин МСМ приходится на непропорциональное количество анального секса и анального рака.
Недавние новые данные свидетельствуют о том, что анальная ВПЧ (в том числе интра-анальная и пери-анальная ВПЧ) распространена. Nyitray et al. 2008
[15] сообщили, что распространенность ДНК ВПЧ, обнаруженная у 222 гетеросексуальных мужчин, составила 16,6% для анального канала и 21,3% для перианальной области. Из пациентов с анальной инфекцией ВПЧ у полностью 33,3% был онкогенный высокоинфекционный HR-HPV-тип (как определено работой рака шейки матки и его предшественников). Недавнее исследование, проведенное той же группой, о мужчинах из Бразилии, Мексики и США распространило эти результаты
[16]. Сравнивая только ВИЧ-отрицательных мужчин (1305 гетеросексуальных против 176 гомосексуалистов), они обнаружили распространенность ВПЧ анального канала в 12,2% и 47,2% соответственно. Два предыдущих исследования, изучающих гетеросексуальных мужчин, т. Е. Van Doornum et al. 1994
[17], и Nicolau et al. 2005
[18], сообщили о распространенности анального ВПЧ-ДНК в 35% от 85 мужчин и 8% мужчин соответственно. Большие несоответствия, скорее всего, связаны с различиями в технике, выборке образцов, разных когортах и, в частности, с использованием доступных в настоящее время высокочувствительных ПЦР и линейчатых анализов с шагами амплификации.
Анальные данные о ВПЧ-инфекции у ВИЧ-отрицательных женщин несколько лучше документированы. Наилучшие доступные данные взяты из исследования когорты Hawaii HPV Cohort; Hernandez et al. 2005
[19] сообщили об уровне распространенности 27% анальной инфекции ВПЧ в этой когорте. Одна и та же группа сообщила, что в течение среднего периода наблюдения в 1,3 года у 70% женщин развилась инфекция анального ВПЧ-инфекции
[20]. Moscicki et al. 1999
[9] сообщили, что 66,7% женщин с аномальной анальной цитологией обнаруживали ВПЧ по сравнению с 12,7% женщин с нормальной анальной цитологией. Наконец, группа Палефского
[14] сообщили о распространенности 42% в когорте ВИЧ-отрицательных женщин с высоким риском поведения. Поэтому данные медленно накапливаются, что инфекция анальной области с ВПЧ как у гетеросексуальных мужчин, так и у женщин, не инфицированных ВИЧ, относительно распространена.
Исследования естественной истории и данные о роли стойкой анальной инфекции с ВПЧ у обоих полов значительно меньше, чем у женщин при раке шейки матки. Наибольшее постоянное продольное исследование у женщин заключается в том, что исследователи когорты Гавайских ВПЧ, где они показали, что у 431 женщины (с 4-месячными интервалами) 50% имели инфекционную анальную инфекцию в течение средней продолжительности 1.2 лет
[21]. Средняя продолжительность заражения подтипом высокого риска составляла 150 дней. Эта группа также продемонстрировала, что после первичной инфекции шейки матки секреция инфекции ВПЧ-инфекции, вероятно, будет последовательно получена, и что анальная инфекция очищается у 87% женщин в течение 1 года
[22]. Это меньше, чем обычно сообщаемая частота для шейки матки (~ 90% очищается на 2 года)
[23]. Интересно, что одно исследование показало, что 6-месячная персистенция HPV 16 отсутствовала у гетеросексуальных мужчин, тогда как у 5,1% пациентов с МСМ
[24].
Эти данные могут частично объяснить вывод о том, что частота раковых заболеваний значительно ниже, чем при раке шейки матки, если мы согласны с гипотезой о том, что персистирующая инфекция с ВПЧ также необходима для развития анального рака. Высококачественный AIN (HGAIN) можно идентифицировать с помощью аноскопии высокого разрешения (HRA) или кольпоскопии ануса и перина после применения 3-5% уксусной кислоты. Тем не менее, по сравнению с количеством цервикальных кольпоскопов в настоящее время значительно меньше квалифицированных специалистов в области HRA, и это отчасти объясняет, почему еще меньше данных публикуется о распространенности HGAIN среди населения в целом. Поскольку нет рекомендаций по скринингу, многие пациенты либо диагностируются с успехом во время операции при доброкачественных анальных состояниях, либо иногда во время колоноскопии или при наличии анальных симптомов
[25,26].
Высокоуровневая внутриэпителиальная неоплазия на всех аногенитальных участках (анус, шейка матки, влагалище, вульва, пенис), вероятно, будет предшественником инвазивного рака на этом участке, но потенциал для прогрессирования лучше всего задокументирован в шейке матки в результате большое неэтичное исследование, в котором в период 1955-1976 годов окончательное лечение CIN 3 было удержано у значительной когорты новозеландских женщин. Кумулятивная частота рака шейки матки или вагинального хранилища в этой группе составила 31,3% в 30 лет по сравнению с 0,7%, получавших адекватное лечение
[27]. Очевидно, что такое исследование нельзя дублировать на других сайтах, но прогрессирование AIN в анальный ГТК было оценено в небольших исследованиях с наблюдением и лечением, но с относительно небольшим наблюдением в течение 5-10 лет. Выделяются два исследования, посвященные ВИЧ-негативным группам. Группа Шолефилда
[28] опубликовал в когорте 35 ВИЧ-отрицательных пациентов (26 женщин и 9 мужчин) с AIN 3 и продолжил медианную продолжительность 63 месяца (от 14 до 120 месяцев). Медианный возраст составлял 43 года (от 31 до 62 лет). Три из этих 35 пациентов (8,5%) развили инвазивную карциному на участках предыдущей болезни AIN 3, и все три были системно иммуносупрессированы от длительной пероральной терапии. Авторы предполагают, что у пациентов с ослабленным иммунитетом (6 в этом исследовании — все из длительной пероральной терапии, такие как кортикостероиды, для различных состояний) и пациентов с мультифокальным АИН (7 в этом исследовании) подвергаются более высокому риску злокачественной трансформации. Этот показатель злокачественной конверсии не слишком отличается от показателя, наблюдаемого при превращении VIN 3 в рак вульвы (~ 9% в течение 5 лет)
[29].
Другое важное исследование показало, что у кого-то из 72 пациентов с AIN, а затем для медианы 60 месяцев (диапазон 18-112 месяцев) и с медианным возрастом 49 лет (от 18 до 81 года)
[30]. 8 пациентов прогрессировали до инвазивного SCC, 2 из AIN 2 (10 пациентов) и 6 из AIN 3 (45 пациентов). Ни один из 17 пациентов с AIN 1 не прогрессировал от рака в течение последующего периода. Двадцать пять пациентов понизили свои поражения. Авторы полагают, что, поскольку 13% пациентов с AIN 3 превращаются в рак в течение последующего периода, необходимо, чтобы все AIN 3 находились под пристальным наблюдением. Однако данные этих двух небольших исследований показывают, что даже при эпиднадзоре и лечении в среднем 9-13% AIN 3 может прогрессировать до инвазивного заболевания в течение 5-10 лет, что сопоставимо с наблюдаемым для прогрессирования CIN 3 за аналогичные периоды времени.
Однако недавний метаанализ показал, что показатели прогрессирования от HGAIN до анального рака составляют примерно один из 600 в год среди ВИЧ-инфицированных МСМ и один в 4000 в год у ВИЧ-отрицательных пациентов с МСМ
[31], существенно ниже, чем у 80 в год, наблюдаемых при сопоставимых заболеваниях шейки матки
[27]. Одним из возможных объяснений этого несоответствия является то, что эти оценки были основаны на нескольких исследованиях поперечного сечения и общих показателях распространенности показателей заболеваемости HGAIN и анального рака, а не на предполагаемых последующих исследованиях. Однако нельзя исключать, что HGAIN может регрессировать чаще, чем CIN 3, возможно, частично объясняется тем фактом, что HGAIN включает как AIN 2, так и AIN 3, причем AIN 2, вероятно, содержит смесь типов HG и LG HPV.
Имеются сильные вспомогательные данные для утверждения о том, что HGAIN является поражением предшественника инвазивной анальной карциномой. Однако имеются ограниченные данные о распространенности HGAIN среди населения в целом. Существуют также некоторые данные, дающие оценки естественного прогрессирования AIN в инвазивный рак в разные периоды наблюдения. Наконец, продолжаются текущие и очень недавние исследования по анальной инфекции ВПЧ в группах традиционно не высокого риска, которые помогают избежать простой экстраполяции данных из групп высокого риска в общее сообщество. В настоящее время существует потребность в многоцентровых проспективных исследованиях по прогрессированию AIN 3 для рака и эффективности лечения для снижения частоты развития анального рака.
ВПЧ: папилломавирус человека; ВИЧ: вирус иммунодефицита человека; CIN: цервикальная внутриэпителиальная неоплазия; AIN: анальная внутриэпителиальная неоплазия; МСМ: мужчины, имеющие половые контакты с мужчинами; VIN: вульварная внутриэпителиальная неоплазия; OR: отношение шансов; RR: относительный риск; SCC: плоскоклеточная карцинома.
MAS выступает в качестве консультанта Sanofi Pasteur-MSD, Lyon, France и MAS, а PKCG ранее получали образовательный грант от Sanofi-Pasteur MSD. MAS также выступает в качестве консультанта Merck Research Laboratories, Westpoint, USA и GSK Biologicals, Rixensart, Бельгия. Эта работа была поддержана грантами британского фонда кожи (ref: 806), благотворительного фонда Addenbrooke’s Charities Trust (ref: 25 / 09CB) и Cancer Research UK (ref: C26262 / A8633) для PKCG.
Все авторы внесли значительный вклад в эту работу и увидели и утвердили окончательное содержание статьи.
Доступ к этой публикации можно получить здесь:
хттп://ввв.биомедцентраль.ком/1471-2407/12/398/препуб
Источник
Рак кишечника все чаще поражает молодых людей. Это связано с изменениями в образе жизни, питанием и экологическими факторами. Рак кишечника — вторая по распространенности причина смерти от онкологических заболеваний после рака легких.
В России только рак толстой кишки выявляется у 25-30 тыс. пациентов в год.
Несмотря на то, что раковые опухоли кишечника развиваются довольно медленно, рак кишечника протекает практически бессимптомно, что резко повышает его смертоносность.
Из-за поздней диагностики летальность при раке кишечника достигает 40% в течение года с момента выявления болезни. Наиболее частым органом, в который метастазирует рак, является печень. Это обусловлено особенностями венозного оттока от кишечника, который осуществляется через систему воротной вены печени.
В Европе и США с 2008 по 2016 год на 7,4% возросло количество случаев рака кишечника среди молодых людей 20-39 лет,
выяснили специалисты из Медицинского центра университета Эразма Роттердамского. Среди пожилых людей при этом заболеваемость снизилась — регулярные осмотры позволили вовремя обнаруживать угрожающие здоровью состояния и, по возможности, снижать риски.
По мнению онкологов из Массачусетской больницы общего профиля, в повышении риска развития рака кишечника у молодых людей ведущую роль играет ожирение — по крайней мере, у женщин. С 1980 года они наблюдали за 85 тыс. женщин, которым на момент начала исследования было от 25 до 44 лет. К 2011 году исследователи зафиксировали 114 случаев рака кишечника, поразившего женщин моложе 50 лет.
Индекс массы тела — показатель соответствия роста и веса человека, рассчитываемый по специальной формуле. Его норма — 18,5-24,99. ИМТ 25-30 говорит об избыточной массе тела, более 30 — об ожирении.
В исследовании говорится, что женщины с ИМТ выше 30 страдали от рака кишечника в два раза чаще остальных.
Также распространение рака кишечника связано с вирусом папилломы человека. В первую очередь он известен как вирус, вызывающий рак шейки матки, однако из-за схожести эпителия шейки матки и анального канала он способен спровоцировать рак и в прямой кишке. К заражению приводят половые связи без должной защиты.
Ранее исследователи из Венского медицинского университета обнаружили в кале жителей большинства стран микропластик. По словам доктора Герберта Тильга, президента Австрийского общества гастроэнтерологии, микропластик может быть одним из факторов, способствующих воспалению кишечника и даже раку толстой кишки.
«Риск развития рака толстой кишки у молодых людей растет, и мы связываем это с питанием и экологическими факторами, — сказал он. — Теперь, когда мы знаем, что в организме человека можно обнаружить микропластик, мы можем провести более масштабные исследования как со здоровыми, так и с больными людьми, чтобы выяснить, какую роль в развитии болезни он играет».
Провоцировать рак кишечника и желудка может красное переработанное мясо. Это связано с тем, что производители пытаются продлить срок хранения мяса с помощью нитратов и нитритов, которые являются канцерогенами.
Один из первых признаков рака кишечника — расстройство стула.
Длительные запоры сменяются диареей, живот постоянно вздут. Этот признак характерен для онкологии левой половины слепой или ободочной кишки. В кале могут присутствовать следы крови. Также возникает диспепсия — нарушение нормального пищеварительного процесса, когда пациент мучается изжогой, горьким вкусом в полости рта, тошнотой и рвотой.
При разрастании опухоли может нарушиться процесс дефекации, новообразование препятствует нормальному выведению кала. На поздних стадиях при поражении соседних органов может развиться цистит. Среди менее специфичных признаков болезни — слабость и утомляемость, сухость и бледность кожи, слизистых, изменение температуры тела.
У женщин могут наблюдаться сбои в менструальном цикле, у мужчин — поражение предстательной железы.
В определенный момент развития болезни симптоматика рака и геморроя схожа. Поэтому, например, в США все пациенты, которые обращаются с кровотечением из прямой кишки, проходят через колоноскопию. В России треть случаев рака кишечника определяется посмертно.
Симптоматика при поражении разных отделов кишечника несколько различается.
Для рака прямой кишки также характерны ложные позывы к дефекации и мочеиспусканию. Поход в туалет может сопровождаться болью из-за поражения опухолью нервных окончаний. Возможны выделения из анального отверстия. По мере роста опухоли пациент страдает от недержания кала, мочи и газов. Если опухоль не дает каловым массам выходить, это приводит к сильной интоксикации организма. тошноте и головным болям.
Рак толстой кишки часто начинается с ноющей боли в подреберье. Живот вздувается, стул становится жидким. В брюшине может собираться жидкость, возможна непроходимость кишечника. В рвоте могут содержаться следы кала. Рак толстой кишки отличается от других видов рака тем, что развивается из полипов, которые могут присутствовать в кишечнике годами. Поэтому регулярные обследования с целью выявления полипов помогут «поймать» рак на ранних стадиях.
При раке тонкого кишечника каловые массы темнеют, в них содержится большое количество крови. У больного меняются обоняние и вкус, пропадает аппетит. Живот постоянно болит, в кишечнике наблюдаются сильные спазмы.
Эти симптомы не всегда указывают на онкологию, однако должны стать сигналом к неотложному обследованию.
Симптомы обычно проявляются на 2-3 из пяти стадий рака кишечника. На нулевой стадии опухоль небольшая и затрагивает только слизистый слой. На первой стадии она прорастает и в подслизистый слой, на 2-й — дает метастазы в лимфоузлы и прорастает в мышцы. На 3-й стадии опухоль затрагивает уже все слои стенки кишечника. На четвертой — занимает весь просвет кишки и дает метастазы в отдаленные органы.
На 0-1 стадии болезни рак обычно выявляется случайно. На этом этапе от заболевания удается избавиться с вероятностью в 95%. На 2-й стадии шансы падают до 83-52%. На 3-й стадии количество излечившихся составляет не более половины. На 4-й стадии выживает не более 5% пациентов, а срок жизни редко превышает полгода.
Для диагностики рака кишечника необходима колоноскопия или ирригоскопия. При первом методе в кишечник вводится гибкий зонд, во втором — после введения специального раствора, окрашивающего стенки кишечника, делается рентген. Для точного установления локализации, размеров и метастазов опухоли проводится МРТ. Также необходимы анализы мочи и крови, в том числе на онкомаркеры.
На ранних стадиях обычно применяется оперативное лечение, после которого удается полностью восстановить функционал кишечника. Если же опухоль успела разрастись, то приходится удалять значительную часть кишечника, а здоровый участок выводить наружу и формировать колостому — искусственное отверстие для опорожнения.
Зачастую это дискомфортно для пациента и может причинять боль. Если хирургическое вмешательство уже неэффективно, применяется лучевая и химиотерапия. Их задача — уменьшить рост опухолевых клеток и снизить их скорость распространения по организму.
Около 10% случаев рака кишечника обусловлены наследственной предрасположенностью.
Опасны полипы кишечника — риск развития рака начинает увеличиваться через 7 лет от их появления и каждые последующие 10 лет возрастает на 10%, достигая через 25 лет 30%.
Также рак провоцируют заболевания кишечника — болезнь Крона, неспецифический язвенный колит. Повышает риск неправильное питание — преобладание в рационе мясных, жирных и мучных блюд, недостаточное содержание продуктов растительного происхождения. Также в группе риска находятся люди, в течение долгого времени (нескольких месяцев или даже лет) принимающие противовоспалительные препараты и страдающие от хронических запоров.
Повышают риск развития рака кишечника курение, ожирение и алкоголизм. Кроме того, курильщики с раком толстого кишечника имеют в два раза более высокий риск смерти по сравнению с некурящими людьми.
Основные методы профилактики рака кишечника — сбалансированное питание и физическая активность. Также важно отказаться от курения и не злоупотреблять алкоголем. Людям старше 40 лет рекомендуется ежегодное пальцевое исследование прямой кишки, а после 50 лет — колоноскопия раз в 2-3 года. Также в пожилом возрасте стоит особенно внимательно следить, не появится ли в кале кровь.
Источник