Метастазы меланомы без выявленного первичного очага

Меланома из невыявленного первичного очага. Около 3-4% диагностируемых в год в мире меланом приходится на меланому из невыявленного первичного очага. Это такая ситуация, когда уже на первом этапе, при обращении пациента, выявляются метастазы меланомы, но при этом не удается обнаружить первичный очаг, опухоль, которая стала источником метастазов.
Связана такая ситуация с тем, что меланома бывает не только на коже – это во-первых, а во-вторых, с тем, что первичная меланома – опухоль, которая может подвергаться спонтанному регрессу, частичному или полному. Иногда при меланомах из НПО мы обнаруживаем нечто, что морфологи диагностируют нам как полностью регрессировавшую меланому, иногда нет.
Следует оговориться, что даже полный регресс первичной меланомы не связан с каким-либо улучшением прогноза. Процесс метастазирования опухоли может идти одновременно с ее регрессом, и регресс первичной меланомы не ассоциирован с регрессом метастазов опухоли.
Когда диагностируют метастазы меланомы из НПО, это трактуется как четвертая, последняя, стадия заболевания, то есть, как стадия с заведомо неблагоприятным прогнозом. В принципе, это такой вариант фатального невезения, когда пациенту практически нельзя помочь изначально, потому что нельзя своевременно обнаружить болезнь, и предотвратить ее развитие.
Однако, не все меланомы из невыявленного первичного очага в действительности являются таковыми.
Намедни коллега попросил меня посмотреть своего пациента. История пациента довольно интересная и в чем-то поучительная, поэтому я и решил ее опубликовать.
Пожилой мужчина обратился к врачу в связи с жалобами на нарастающую слабость, лихорадку по вечерам, потерю аппетита и веса. При обследовании у него были выявлены увеличенные лимфоузлы, в связи с чем было предположено лимфопролиферативное заболевания: опухоль из лимфоидной ткани, поражающая лимфатическую систему. Для подтверждения диагноза пациент был госпитализирован в клинику, где ему была выполнена диагностическая лапароскопия и биопсия одного из пакетов лимфоузлов. Лимфопролиферативные опухоли порой довольно хорошо лечатся с использованием химиотерапии, поэтому необходимо было подтвердить диагноз, чтобы подобрать правильную схему лечения. Решение о лечении отложили до результатов гистологического исследования удаленных лимфоузлов.
Результат, однако же, оказался несколько неожиданным. По данным гистологических исследований, лимфоузлы оказались поражены не лимфомой. В них были верифицированы метастазы меланомы.
Пациент был повторно госпитализирован для дообследования. Как видно из следующего ниже документа, объем поражений значителен.
При дообследовании пациента не была выявлена первичная меланома, поэтому заключительный диагноз так и формулируется: «меланома без выявленного первичного очага с поражением лимфоузлов средостения, брюшной полости, малого таза».
Ситуация, разумеется, не хирургическая, лечить такого пациента можно только с использованием химиотерапии, либо таргетной терапии, рассчитывая на то, что лекарственные препараты будут бороться с опухолью системно. У пациента в опухоли была выявлена мутация в 3-м экзоне гена N-ras, в связи с чем он был направлен для лечения к нам.
Коллега его раздел полностью, осмотрел, на этом этапе и позвал меня.
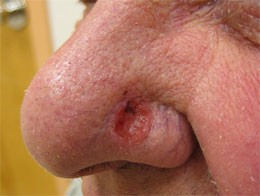
Первичная меланома у пациента благополучно нашлась. Она расположена у него на подошве, на месте, которое не часто подвергается осмотрам. Вот такая, крупная, запущенная опухоль.
При дерматоскопии видно, что изначально это была пигментная опухоль, видны остатки меланоцитарных паттернов, видны участки, где опухоль уже потеряла дифференцировку, и в ней перестал вырабатываться меланин, обеспечивающий меланоме черную окраску.
Надо сказать, что пациент несколько сопротивлялся осмотру. Утверждал, что «нет там у него ничего», что «родинка» эта у него уже с десяток лет, и никогда не беспокоила.
Что из всего этого следует? Конечно, если бы в направляющей клинике выявили бы первичную меланому, на данном этапе болезни для пациента бы уже ничего не изменилось. Просто иначе был бы сформулирован диагноз. Не меланома из НПО с поражением лимфоузлов средостения, брюшной полости и малого таза, а меланома кожи стопы с поражением все тех же лимфоузлов. Непринципиальное отличие.
Изменить что-то можно было раньше. Лет десять назад. Когда только начала расти первичная меланома. Если бы пациент был минимально информирован об опасности родинок вообще. Если бы пациента полностью, включая стопы, осмотрел какой-нибудь врач. Если бы…
Увы, история болезни, как и история вообще, сослагательного наклонения не терпит.
Мы не можем вернуться вспять и изменить уже произошедшие события, можем только учитывать эти события, да делать выводы на будущее. В современном мире преимущество в выживании имеет тот, кто больше информирован. О финансах, о налогах, о криминогенной обстановке, об уголовном кодексе, о правилах дорожного движения, об устройстве своего автомобиля… и о здоровье, о симптомах опасных заболеваний. Не нужно мне в комментах писать, что пациент, дескать, дремучий. Нормальный пациент. Просто он не знал. Пожилой мужчина, 69 лет. Не пользовался интернетом, активно не обращался к врачам. Ну, росло что-то на стопе, и росло: на вид, вроде, не угрожающее, не болело, не беспокоило, он и не обращался. Просто не был информирован, что такое бывает. Никто из нас не информирован обо всем, о всех опасностях этого мира.
Единственный рецепт, который тут можно дать: больше читайте. Научно-популярных блогов, статей, книг. Любая усвоенная информация о любой области жизни может однажды оказаться полезной, однажды – спасти жизнь вам или кому-то из ваших родственников.
На этом всё.
UPD. И да, совсем забыл. В России скоро – Всемирный день диагностики меланомы, в ходе которого каждый может пройти бесплатный осмотр у врача дерматолога-косметолога. Подробности тут: https://www.melanomaday.ru/
Также рекомендую почитать этот свой пост: https://dr-jamais.livejournal.com/189087.html
Источник
Авторы: В.Ш.Рзаева, Г.И.Гафтон, В.В.Анисимов, М.Ю.Мяснянкин, Ю.В.Семилетова, И.Г.Гафтон
ФБГУ «НИИ онкологии им. Н.Н. Петрова» Минздрава РФ, Санкт-Петербург
Сибирский онкологический журнал
Меланома кожи представляет собой злокачественную опухоль, возникающую в результате неопластической трансформации меланобластов, меланоцитов и невусных клеток, являясь первым локальным проявлением общего неопластического заболевания всей меланоцитарной системы организма человека [1]. Известно, что меланома может локализоваться не только в коже, но и в других органах и тканях. По данным ряда авторов меланома поражает кожу приблизительно в 87 % наблюдений, сосудистую оболочку глаза – в 7%, а также слизистые оболочки носа, ротоглотки, пищевода, вульвы, влагалища, нижнеампулярного отдела прямой кишки, мочевого пузыря и уретры [2, 3].
У некоторых больных меланомой ее первое клиническое проявление может выражаться возникновением метастазов в лимфатических узлах, в мягких тканях или во внутренних органах. Несмотря на тщательное клиническое обследование этих пациентов или даже данные аутопсии, выявить у них первичную опухоль не удается. В онкологической практике такая клиническая форма заболевания получила название метастазов меланомы без наличия клинически определяемой первичной опухоли (ММБПО).
Возникновение у больных метастазов без клинически определяемой первичной злокачественной опухоли не является клинической особенностью, характерной только для меланом. Частота случаев, когда онкологическое заболевание диагностируется по наличию метастазов, а локализация первичной опухоли даже при тщательном патологоанатомическом исследовании остается неизвестной, составляет от 3 до 15 % случаев от всех онкологических заболеваний [4, 5, 6, 7, 8]. Причем гистологически в пораженных метастазами лимфатических узлах в 50-80 % обнаруживаются клетки плоскоклеточного рака, в 20-40 % – клетки аденокарциномы и в 10-15% – меланомы.
Возникновение метастазов меланомы без клинически определяемой первичной опухоли патогенетически может быть обусловлено исчезновением первичной меланомы кожи в процессе ее травматизации или полного разрушения, спонтанной регрессии и беспигментного варианта течения. По данным ряда авторов, клинические и гистологические проявления частичной спонтанной регрессии наблюдаются у 10-56 % больных первичной меланомой кожи. Полная спонтанная регрессия первичной опухоли у больных меланомой кожи представляет собой казуистику и встречается в 0.3 % наблюдений [9, 10].
Также по литературным данным причинами отсутствия первичной опухоли являются невозможность визуально дифференцировать первичную опухоль от доброкачественных пигментных невусов, локализация ее в глубоких слоях кожи, а также во внутренних органах и в лимфатических узлах в результате дисонтогенеза или захвата меланоцитов лимфатическими узлами в течение жизни человека [3, 4].
Пациенты с ММБПО являются небольшой составной частью больных меланомой. Она составляет приблизительно от 1% до 8% от всех случаев меланомы и до 12,6% среди всех случаев метастазов рака без клинически определяемой первичной опухоли [10, 11, 12].
Впервые термин «метастаз рака без клинически определяемой первичной опухоли/ metastasis cancer of unknown primary tumor» был предложен в 1963 году Das Gupta и коллегами при проведении широкого исследования группы пациентов с метастазами меланомы неизвестной первичной опухоли [13].
В настоящее время в литературе можно встретить целый ряд терминов, обозначающих «метастаз рака без клинически определяемой первичной опухоли» (син.: «метастаз рака с неизвестным первичным очагом», «метастаз рака из не выявленного первичного очага», «cancer of unknown primary», «tumor of unknown primary», «unknown primary origin», «оссult primary» и другие), смысл которых в разных публикациях может существенно изменяться в зависимости от использованных методов обследования больных [3, 4, 6, 13].
Мы, как и большинство авторов, под метастазами меланомы без клинически определяемой первичной опухоли подразумеваем те случаи, когда первичная меланома остается невыявленой как при первичном обследовании пациента, так и в течение всего его лечения.
Для научного обоснования оптимальной стратегии диагностики и лечения ММБПО необходимы рандомизированные исследования, которые в силу специфики этой патологии до сих пор не проводились, однако к определенным выводам все же можно прийти на основе анализа немногочисленных публикаций.
У пациентов с ММБПО, при обращении, могут иметь место как метастазы в лимфатических узлах, так и метастазы во внутренние органы. По некоторым наблюдениям до 75 % больных метастазы локализовались более чем в 5 органах [3, 14, 15].
По данным литературы наиболее частым является метастазирование в периферические лимфатические узлы. Метастатическому поражению подвержены любые группы лимфатических узлов. Однако авторы отмечают, что у таких больных чаще поражаются подмышечные лимфатические узлы (25,3%), в 1 случае отмечено двустороннее поражение. Лимфоузлы шеи поражались в 29,4% случаев, в 1 наблюдении двустороннее поражение; в 2,9% случаев – лимфоузлы шеи; в 14,7% – паховой области, в 8,8% – пахово-подвздошной области, в 8,8% – поражение более двух коллекторов лимфатических узлов. В 69,1% случаев отмечено множественное поражение лимфатических узлов, а в 17% случаев имелись висцеральные метастазы. Исследователям удалось установить, что ММБПО в 2,5-3 раза чаще встречаются у мужчин (64,7%), нежели чем у женщин (35,3%). Возраст больных составлял от 17 до 79 лет, в среднем 42,3 года. Продолжительность анамнеза составляла от 1 месяца до 3 лет, в среднем 5,1 месяцев [7, 12,16,17,18].
При анализе анамнетических данных отмечено, что у 42,9% больных на коже имелись различные пигментные образования. Из них у 11,8% больных отмечено травматическое повреждение пигментного образования с последующей спонтанной регрессией опухоли, а у 14,7% – спонтанная регрессия без травматического повреждения. В 11,8% случаях при поступлении в клинику на коже имелся депигментированный участок от 0,2 до 1,5 см в диаметре, у 3,3% больных – рубец после травмы пигментного образования. Таким образом, все пациенты с ММБПО могут быть условно разделены на две группы. Первая группа представлена больными с первичной меланомой, которая по своим размерам, скрытой локализации и метаболической активности находится вне пределах диагностических возможностей и поэтому не может быть обнаружена. Ко второй группе относятся больные со спонтанно регрессированной или механически разрушенной и к моменту наблюдения полностью отсутствующей первичной меланомой. По данным ряда авторов [3, 4, 19] частичная или полная самопроизвольная регрессия первичной меланомы может иметь место в 15 % случаев. Время от спонтанной регрессии пигментных образований кожи до появления увеличенных лимфатических узлов составило от 1 года до 17 лет, в среднем 3 года [16].
В свое время физикальное обследование являлось основным и единственным методом в поиске первичной меланомы. Но, к сожалению, на сегодняшний день, такое обследование является недостаточным в связи с возможными микроскопическими размерами первичной меланомы [1]. Учитывая тот факт, что меланома относится к категории нейроэктодермальных опухолей и часто располагается не только на коже верхних и нижних конечностей, туловища и головы, а так же встречается на сосудистой оболочке глаза и слизистых оболочках внутренних органов, пациенты с ММБПО наряду с осмотром кожных покровов, обязательно должны быть подвергнуты тщательному клиническому обследованию слизистых оболочек и внутренних органов. [3, 12]. Еще в 1963 году Das Gupta предложил включить в медицинские осмотры пациентам с ММБПО офтальмоскопию и осмотр аногенитальной области.
Усовершенствование методов ультразвуковой и эндоскопической диагностики, появление компьютерной (КТ), магнитно-резонансной (МРТ) и позитронно-эмиссионной томографии (ПЭТ) предоставило целый ряд новых возможностей для визуализации новообразований и выявления скрытых опухолей. В литературе встречаются оценки эффективности совместного применения КТ и МРТ, а также ПЭТ и КТ в диагностике пациентов с ММБПО [20, 21]. Чувствительность совместного применения этих методов составляет 71%, специфичность – 73% и точность – 72%. Однако установить локализацию первичной опухоли удается далеко не во всех случаях. Многие авторы [22, 23, 24, 25, 26] сообщают, что до трети пациентов получают лечение по поводу метастазов меланомы без клинически определяемой первичной опухоли после всестороннего клинического обследования, панэндоскопии, КТ или МРТ мягких тканей и ПЭТ.
Выполнение тонкоигольной аспирационной (ТАБ), инцизионной, эксцизионной или трепан-биопсии пораженного лимфатического узла является необходимой процедурой для морфологической верификации диагноза при метастазах рака без клинически определяемой первичной опухоли в ряде специализированных учреждений является стандартным этапом обследования больных.
Цитологическое исследование пунктата измененного лимфатического узла, по некоторым данным, более чем в 65,7% случаев подтверждает опухолевый процесс [27]. Наиболее рациональным является выполнение трепан-биопсии под ультразвуковым контролем, что повышает вероятность получения информативного материала для морфологического исследования [28].
Другой перспективной возможностью использования биопсийного материала является выполнение иммуногистохимического и молекулярно-генетического анализа [26, 29, 30].
Иммуногистохимическое исследование (ИГХ) прочно вошло в клиническую практику при различных онкологических заболеваниях и является определяющим для верификации процесса, дифференциальной диагностики и определения тактики дальнейшего лечения и прогноза.
В настоящее время определена следующая иммуногистохимическая картина при метастазах меланомы: характерным является экспрессия Vimentin, protein S100(A4) в опухолевых клетках, а также наличие специфических меланоцитарных маркеров: PanMelanoma (Cocktail, of HMB-45, Mart-1 and Tyrosinasа), Мelan-A (A103), Melanosomа (HMB45), MITF-M (microphthalmia transcription factor Melan-A), Tyrosinasa (Tyrosinasа-related proteins 1 and 2), в 3–10 % может наблюдаться экспрессия PanCK(AE1/AE3). К прогностическим маркерам меланомы относятся p53, Ki67, белки теплового шока, bcl 2, VLA-, a-v/b-3 интегрины, CD 26, NM 23, E-кадгерин, циклин D1, циклин D3, p16INK-4a, фактор VIII, CD 31, CD 34, подопланин, С-kit [31, 32].
Молекулярно-генетическое исследование – флуоресцентная in situ гибридизация (FISH) с определением состояния генов RREB1(6p25), MYB(6q23), CCND1(11q13), CEP6 устанавливает генетические нарушения, позволяет улучшить диагностику меланоцитарных поражений кожи, установить предмеланомные процессы (невусы с пограничными диспластическими изменениями), а также проводить дифференциальный диагноз между меланомой и немеланоцитарными новообразованиями.
Для меланомы характерны следующие параметры: среднее количество гена CCND1 на ядро ≥2,5; процент ядер с «ненормальным» количеством гена RREB1 (т.е. ядра с сигналами RREB1 более или менее 2) ≥63 %; процент ядер с потерей гена MYB относительно CEP6 ≥31 %; среднее количество гена MYB на ядро ≥2,5. Генетические нарушения присутствуют как на ранней стадии формирования опухоли (фаза радиального роста), так и на более поздней (фаза вертикального роста). При этом степень выраженности этих нарушений не зависит от фазы развития опухоли. Помимо этого, отмечено существование меланом с преобладающим типом нарушений: с амплификацией или с делецией исследуемых генов. Также было установлено, что в наибольшей степени (в 72,1 %) подвержен аберрациям ген RREB1. Не менее чем у 50 % больных меланомой обнаруживаются мутации гена BRAF V600E, NRAS, C-KIT, которые играют важную роль для дальнейшей тактики лечения [26, 31, 32].
Таким образом, можно прийти к заключению, что иммуногистохимический и молекулярно-генетические анализы представляются перспективными и требуют включения их в стандарты диагностики ММБПО.
Следует отметить, что в настоящее время в литературе проблема ММБПО мало освещена. Не существует единого мнения относительно методов хирургического и/или комбинированного лечения метастазов, включая системную лекарственную терапию [3, 12, 14, 16]. А отдаленные результаты лечения таких больных нельзя признать удовлетворительными
Тактика лечения пациентов с ММБПО предусматривает, в первую очередь, определение первичной опухоли и устранение ее и метастатического очага хирургическим путем вне зависимости от статуса первичной опухоли, с последующей морфологической верификацией и уточнением уровня дифференцировки опухоли и ее метастатической активности.
Объем лимфатических диссекций при метастазах в регионарный коллектор принципиально остается тем же, что и при опухолях установленной локализации.
Из данных анализа, проведенного в 2011 году Зинченко С.В. известно, что только 19 пациентам хирургическое лечение было дополнено иммунотерапией (3 млн. ЕД через день не менее 6 мес.). Пациентам, имевшим органное распространение метастазов, была проведена монохимиотерапия дакарбазином 2-6 курсов.
Средняя продолжительность жизни пациентов, получивших только хирургическое лечение, составила 27,7±5,1 (17,6-37,8). У пациентов, чье лечение было дополнено химиотерапией (иммунотерапией) – 32,8±5,8 (21,5-44,2). Общий показатель средней продолжительности жизни пациентов с метастазами меланомы без выявленного первичного очага составил 27,0±3,8 (19,6-34,3).
По данным ряда авторов [33] при медиане наблюдения в 7,7 лет, результаты 5-летней и 10-летней общей выживаемости составили 55% и 44%, соответственно.
Результаты зарубежных исследований свидетельствуют о том, что ситуация значительно улучшилась за последние 5 лет после внедрения в клиническую практику современных высокоэффективных препаратов. В 2011 году в результате клинических исследований FDA был утвержден вемурафениб – селективный ингибитор BR5d11AF-киназы (при мутации BRAFV600E), а в 2013 г. – дабрафениб (также ингибитор BRAF-киназы) и траметиниб (MEK ингибитор). Препараты обладают высокой эффективностью, но эффекты в большинстве случаев кратковременны [34, 35, 36].
Данные доклинического исследования показали возможность использования антител, которые блокируют PD-1 (Programmed cell death 1) и PD-L1 (Programmed death-ligand 1), для лечения различных опухолей [37, 38]. В настоящее время зарегистрированы или проходят клинические исследования несколько препаратов, блокирующих PD-1 или рецептор PD-L1: Pembrolizumab (MK-3475) IgG4 генно-инженерные антитела, Nivolumab (MDX1106, BMS-936558) IgG4 человеческие антитела, Pidilizumab (CT-011) IgG1 гуманизированные антитела, PD-L1 BMS935559 (MDX-1105) IgG4 человеческие антитела, MPDL3280A IgG1 генно-инженерные человеческие антитела, MEDI4736 IgG1 генно-инженерные человеческие антитела, MSB0010718C IgG1 человеческие антитела [39, 40].
Возможно, что разрабатываемые в настоящее время более специфические иммунотерапевтические подходы (вакцинотерапия, генная терапия) позволят улучшить результаты и таким образом перевести диссеминированную меланому из разряда резистентных опухолей в чувствительные [41].
Но остаются неоднозначными суждения в отношении прогноза при метастазах меланомы без клинически определяемой первичной опухоли [42]. Наиболее часто в качестве прогностических факторов рассматриваются спонтанная регрессия, число пораженных лимфатических коллекторов, число пораженных лимфатических узлов в пределах одного коллектора, размеры метастазов, возраст больных.
Следует отметить, что даже полный регресс первичной меланомы не связан с каким-либо улучшением прогноза заболевания. В европейских исследованиях описаны наблюдения, когда метастазы возникали спустя 10 лет и более после самопроизвольной регрессии первичной меланомы кожи [19].
Рядом авторов отмечено, что у пациентов, переживших 5-летний срок наблюдения, имело место изолированное поражение метастазами только одного лимфатического коллектора. Всем этим больным было проведено хирургическое лечение, дополненное системной полихимиотерапией. У таких пациентов прогноз заболевания не отличается от такового у больных III стадии заболевания с наличием первичной опухоли. Неблагоприятный прогноз заболевания отмечен при поражении метастазами шейных лимфатических узлов; ни один из пациентов не пережил 5-летний срок наблюдения [3, 16, 43].
Возраст 50 лет и старше, мужской пол и III стадия заболевания были определены как неблагоприятные прогностические факторы [5, 44, 45].
Нельзя оставить без внимания тот факт, что в исследовании, проведенном в США Samadder N.J. и коллегами в 2015 году, представлены случаи наследственной предрасположенности к развитию метастазов меланомы без клинически определяемой первичной опухоли. Их частота составила (ОР 1,28 [95% ДИ 1,01-1,62]) среди 4160 больных с метастазами без клинически определяемой первичной опухоли [18].
Вышеприведенные данные свидетельствуют о том, что проблема метастазов меланомы без клинически определяемой первичной опухоли остается весьма малоизученой. Литературные данные немногочисленны и иногда даже противоречивы. Поэтому необходимы дальнейшие проспективные исследования особенностей клинического течения, разработка оптимального алгоритма диагностики, а также анализ результатов лечения больных с ММБПО.
Источник