Лечение меланомы с браф мутацией

- Частота и виды мутаций в гене BRAF
- Cтатус мутации гена BRAF и выбор тактики лечения
Частота и виды мутаций в гене BRAF
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.
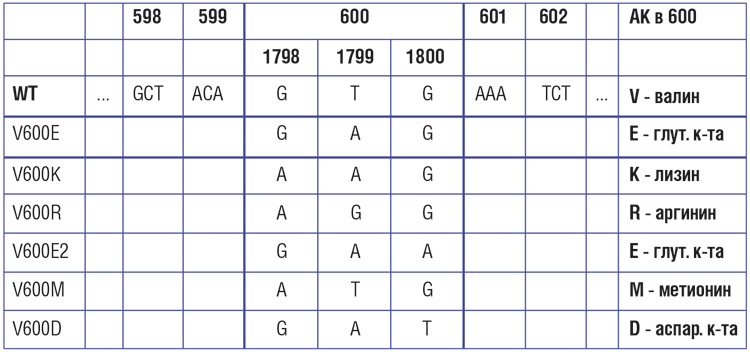
Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
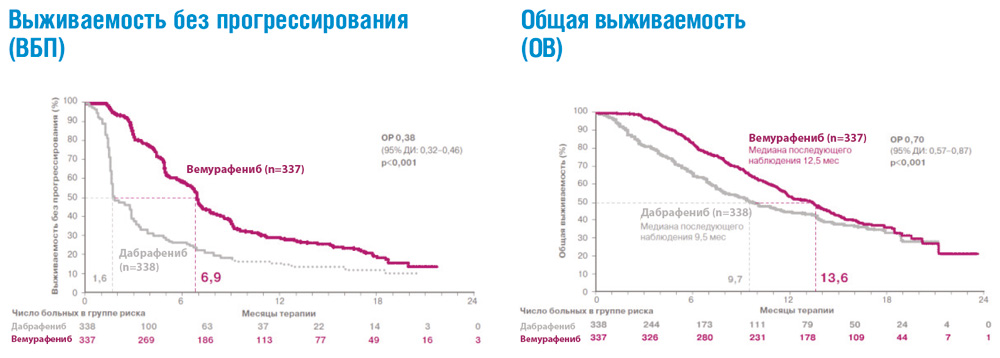
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.
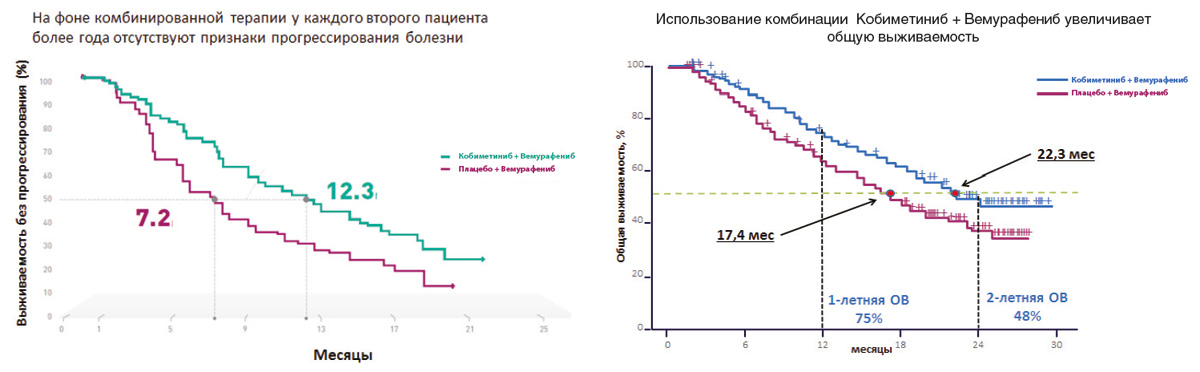
Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
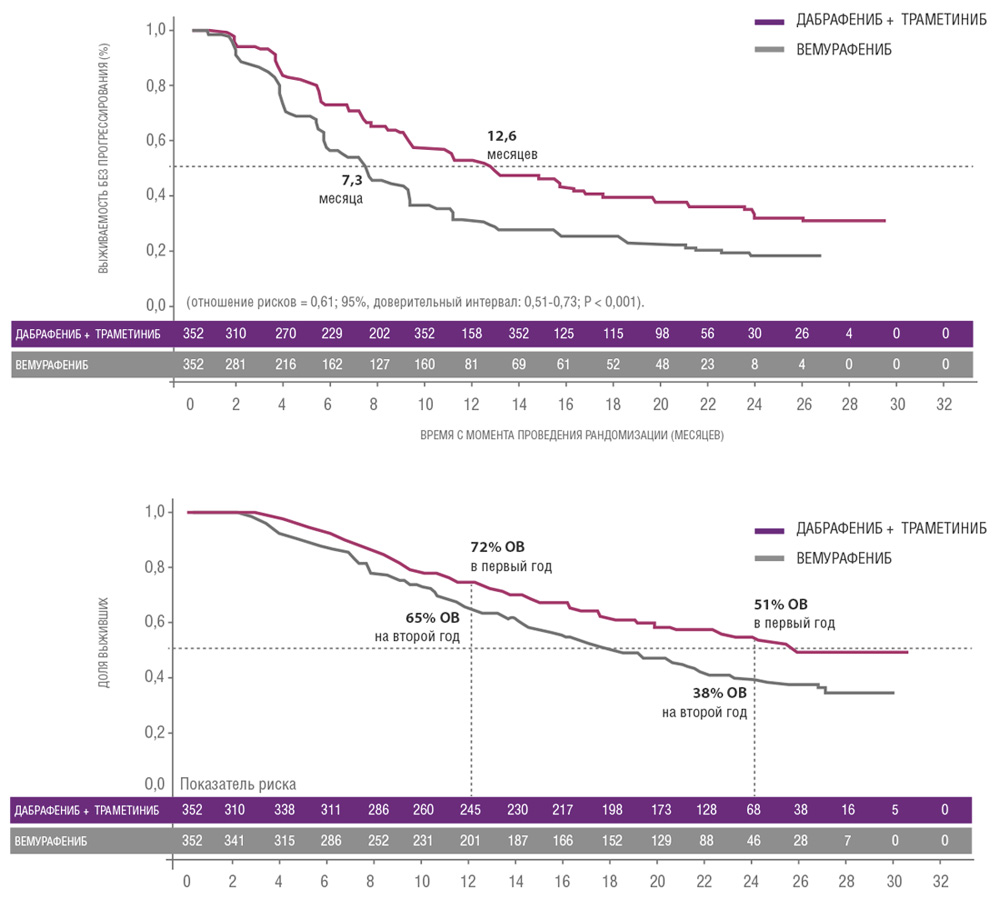
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
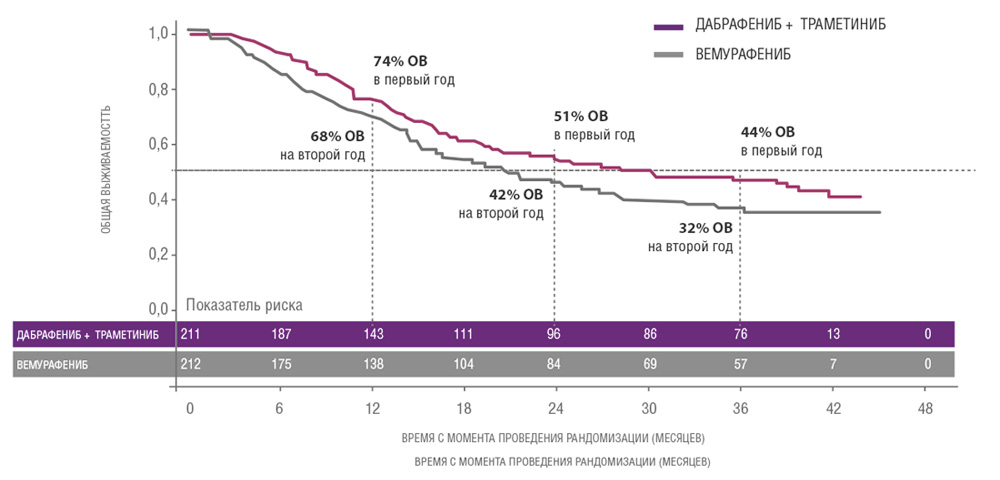
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Статьи:
- Г.Ю. Харкевич. Вемурафениб в лечении метастазов меланомы в головной мозг. Онкология. Журнал им. П.А. Герцена, 6, 2014.
- Г.А. Франк et al, Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив Патологии, 3, 2014.
- С.А. Проценко et al, Современные возможности персонализированной терапии метастатической меланомы кожи. Современная онкология №3, том 16, 2014.
- Larkin J et al. Update of progression-free survival and correlative biomarker analysis from coBRIM: Phase 3 study of cobimetinib plus vemurafenib in advanced-BRAFmutated melanoma; Poster presentation at ASCO 2015.
- Robert C, et al. Ann Oncol. 2015; 26 (suppl 6) [abstract 3301].
- Flaherty K, et al. J Clin Oncol. 2016; 34 (suppl; abstr 9502).
- Hauschild A, et al. Poster presented at ESMO 2014, Abstract 1092PD.
- Robert, C. LBA4 Oral presentation at ESMO 2015.
Источник

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
По данным разных авторов, BRAF мутация встречается от 30% до 70% пациентов, которым поставлен диагноз «меланома». При этом изменения в гене могут быть самыми разнообразными. Всего известно более 40 BRAF мутаций, но наиболее часто (около 90% всех случаев) выявляется замена аминокислоты валина на аминокислоту глутамина в кодоне 600. Соответственно, такая мутация называется BRAF V600E. Второе по популярности изменение в гене при меланоме – это замена аминокислоты валина на аминокислоту аспарагин в том же кодоне. Такая мутация обозначается V600K.
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Запись
на консультацию
круглосуточно
Источник

Выявление различий в мутации гена BRAF с помощью молекулярно-генетических тестов позволяет определить эффективность лечения меланомы. В ходе нового исследования выяснилось, что существуют различия между генотипами мутации меланомы BRAF — V600K и V600E, которые ведут к разным ответам на таргетную терапию и иммунотерапию.
Таргетная терапия при BRAF мутации меланомы V600
Пациенты, которые имеют мутацию меланомы BRAF V600K, меньше поддаются лечению таргетной терапией или ингибиторами BRAF / MEK. В тоже время мутация BRAF V600E позволяет достаточно эффективно лечить меланому в таком случае.
В первой части приняло участие 93 пациента с прогрессирующей меланомой. Пациентам с разными мутациями BRAF проводилось таргетное лечение ингибиторами BRAF / MEK наряду с оценкой уровня эффективности лечения.
Генотипы BRAF — V600K и V600E имеют уникальный молекулярный профиль:
BRAF V600K имеет пониженную экспрессию сигнального пути ERK, большую экспрессию генов P13AKT и значительно большую мутационную нагрузку (количественный показатель, характеризующим число мутаций в 1 мегабазе кодирующего генома опухолевых клеток). Таким образом, он меньшую восприимчивость к подавлению BRAF/MEK.
BRAF V600E обладает более обширной активацией сигнального пути ERK, а также вызывает хороший ответ на подавление BRAF/MEK.
Было отмечено, что при лечении комбинированной терапией с подавлением BRAF / MEK, большинство пациентов в группе с мутацией гена V600K имеют по отношению к группе с V600E:
- низкую частоту ответа на лечение – 31% и 52%
- низкий уровень полного ответа – 0% и 10%.
Пациенты имели следующие показатели выживаемости в подгруппах:
- V600K – медиана выживаемости – 5,7мес ;
- V600E – медиана выживаемости – 7,1мес, при этом около 20% оставались без признаков прогрессирования меланомы через пять лет.
Несмотря на эти численные различия в показателях ответа и выживаемости без прогрессирования, общая выживаемость была одинаковой в обеих группах. Эта часть исследования подтвердила результаты предыдущего исследования, и показывает, что меланома с мутацией V600K имеет более низкий показатель ответа и более короткую выживаемость при лечении таргетной терапией ингибиторами BRAF / MEK.
Иммунотерапия при BRAF мутации меланомы V600
На втором этапе исследования было включено 103 пациента с меланомой, которым проводилась иммунотерапия препаратами пембролизумаб или ниволумаб.
Из этих пациентов исследователи провели неродственную выборку с мутацией меланомы BRAF:
- V600E — 84 пациента;
- V600K – 19 пациентов.
Ответ на иммунотерапию на основе генотипа BRAF коррелировал с клиническими ожиданиями. После медианного периода наблюдения в 31,7 месяца исследователи выявили тенденцию более высокого уровня ответа на иммунотерапию у пациентов с мутациями V600K по сравнению V600E — 53% против 29%. Кроме того, выживаемость без прогрессирования была более длительной у пациентов с подтипом мутации BRAF V600K — 19 против 2,7 месяцев. Тем не менее, общая выживаемость существенно не отличалась — 20,4 против 11,7 месяцев.
Выводы второй части исследования показали, что при мутации меланомы BRAF V600K лучшие результаты показывает иммунотерапия.
Источник: EMED, Израиль
Израильские онкологи активно используют таргетную и иммунотерапию при лечении меланомы. Израиль демонстрирует один из самых лучших показателей в мире по эффективности лечения меланомы.
Источник
Меланому, как и большинство злокачественных процессов, способна вылечить
только операция и преимущественно на ранней стадии развития. Одна из самых
агрессивных опухолей малочувствительна к химиотерапии, но активно реагирует
на противоопухолевую иммунотерапию, которую применяют и для профилактики
рецидива, и при неоперабельном процессе, и при метастазировании.
Чем химиотерапия отличается от иммунотерапии
 Химиотерапия (ХТ) и иммунотерапия (ИТ) убивают опухолевые клетки, только
Химиотерапия (ХТ) и иммунотерапия (ИТ) убивают опухолевые клетки, только
противоопухолевые цитостатики разными способами вмешиваются в жизненный
цикл меланомной клетки, вынуждая её к апоптозу – запрограммированной
смерти. Как показывает практика, вмешательству химиопрепарата опухолевые
клетки активно противостоят, вырабатывая устойчивость к лекарствам.
Иммуно-онкологические препараты тоже приводят злокачественную клетку к
гибели, разными путями активизируя естественную иммунную защиту. Без
участия лекарств опрометчиво надеяться на защиту естественного иммунитета –
он «спит», преднамеренно не реагируя на клетки организма, а раковые клетки
тоже являются «родной» частью организма. Дополнительно опухоль продуцирует
специальные белки, гасящие всякие поползновение к иммунному ответу.
Иммунотерапия позволяет иммунным защитникам увидеть рак и принять меры к
его уничтожению.
Как при меланоме работают иммунные препараты
Иммуно-онкологические препараты – это моноклональные антитела (МКА), то
есть белковые тела, синтезируемые организмом на присутствие вражеского
агента, как правило, бактерии и вирусы. Противоопухолевые МКА –
пембролизумаб (кейтруда) и ниволумаб (опдиво) на поверхности меланомной
клетки блокируют синтез определённых белков, которые позволяют иммунитету
не замечать меланому.
Моноклональное антитело ипилимумаб (ервой) меняет чувствительность главного
иммунного защитника Т-лимфоцита, чтобы он активнее нападал на раковые
клетки.
В терапии меланомы используется естественный белковый продукт –
альфа-интерферон (α-ИФН), синтезируемый клетками организма в ответ на
вторжение вирусов, только в значительно более высоких концентрациях – в
сотни и тысячи раз выше, чем способен воспроизвести весь организм. Не
совсем ясен механизм противоопухолевого действия альфа-интерферона, но в
многочисленных клинических исследованиях получен позитивный результат его
применения для профилактики рецидива.
Таргетные препараты при меланоме
Третья группа противоопухолевых средств – таргетные препараты тоже нацелены
на убийство злокачественных клеток, но через вмешательство во
внутриклеточную биохимическую реакцию. Сбой в одном биохимическом звене
приводит к нарушению всего процесса жизнедеятельности и гибели клетки.
 Предсказатели эффективности применения таргетного лекарства – определённые
Предсказатели эффективности применения таргетного лекарства – определённые
мутации генов в ДНК раковой клетки. При мутации в меланоме гена CKIT будет
польза от таргетного иматиниба. При наличии в злокачественной меланоме
мутации гена BRAF ожидается позитивный результат от использования
кобиметиниба или траметиниба вместе с вемурафенибом или дабрафенибом.
Таргетные препараты используются только при наличии в клетке маркёров –
мутаций, если в течение месяца после операции не удаётся определиться с
генетическим статусом, то считается, что мутация отсутствует.
Когда показана иммунная терапия
После операции профилактическое лекарственное лечение не проводится только
при благоприятной меланоме начальных стадий – I-II, при всех прочих
ситуация необходимо профилактическое лечение, причём начать его необходимо
надо не позже 9 недель после операции. Длительность терапии 1 год, если
пациент способен его переносить.
Профилактику или адъювантную терапию можно проводить альфа-интерфероном или
ипилимумабом (ервой), который в клинических исследованиях показал
неоспоримое преимущество по общей и безрецидивной выживаемости и снижении
вероятности смерти от меланомы.
Противопоказания для проведения иммунотерапии: тяжёлые хронические
заболевания сердца, почек или печени, аутоиммунные процессы и псориаз,
психические болезни и беременность.
Лечение нельзя назвать лёгким, но с течением времени переносимость
альфа-интерферона у большинства улучшается – нормализуется температура,
проходит ломота в мышцах и суставах, но может ухудшиться биохимический
состав крови и остаться слабость.
Лечение распространённой меланомы
При неоперабельной или метастатической меланоме без генной мутации или с неизвестной генетикой лечение
начинают с иммуно-онкологических ниволумаба (опдиво) или пембролизумаба (кейтруда). При невысокой агрессивности
хорошие результаты демонстрирует ипилимумаб (ервой).
При BRAF-мутации в первой линии предлагают таргетную
терапию схемой из двух ингибиторов: кобиметиниб с вемурафенибом или траметиниб вместе с дабрафенибом. При
исчерпании их эффективности или нечувствительности используют МКА: либо
каждые две недели ниволумаб (опдиво), либо через три
недели введения пембролизумаба (кейтруда). И только на
третьей линии прогрессирования меланомы прибегают к химиотерапии.
Положительная мутация гена CKIT основание для выбора в
качестве первого средства ниволумаба (опдиво) или пембролизумаба (кейтруда). При предпочтении пациентом
таблетированных форм можно начать с ежедневного приёма иматиниба. В случае прогрессирования метастатического
процесса переходят на то, что не использовалось в первой линии –
иммуно-онкологические препараты заменяют иматинибом, иматиниб –
иммуно-онкологическими. В третьей линии наступает черёд химиотерапии.
Все лекарственные средства вызывают неприятные побочные реакции, в основном обусловленные всплеском иммунитета, но не только, главное – проводящие лечение онкологи должны иметь достаточный опыт противоопухолевой лекарственной терапии и владеть всем спектром поддерживающей симптоматической терапии. Мы поможем вам найти такого доктора, которому вы доверите свою судьбу. Звоните:8 (495) 256-22-76
Источник

