Диссеминированная меланома кожи что это
Диссеминированная меланома
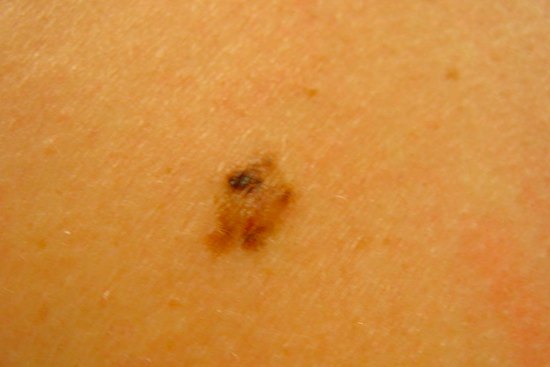
Далеко не все злокачественные новообразования поражают внутренние органы. Так, диссеминированная меланома может формироваться как на слизистых оболочках внутренних органов, так и на поверхности кожи. Это крайне агрессивная опухоль, быстро распространяющаяся на соседние ткани и дающая метастазы в отдаленные органы. Опасной особенностью такого типа опухоли является бессимптомное течение на ранних стадиях роста. Врачебная консультация может пациенту узнать больше о такой патологии, как диссеминированная меланома: факторы риска, способы лечения и осложнения.
Основные сведения о болезни
Меланомой называют злокачественное новообразование, формирующееся из пигментных клеток слизистых оболочек и кожных покровов. Аномальные клетки, формирующие опухоль, являются видоизмененными меланоцитами. Такие клетки располагаются также в области ротовой полости, кишечнике, слизистой оболочке глаз и под ногтями. Иногда ранние признаки заболевания легко обнаружить из-за явного расположения опухоли, однако далеко не всегда диссеминированная меланома берет свое начало от родинки.
Диссеминированная меланома – это не что иное, как распространившаяся опухоль пигментных клеток. Меланобластомы очень быстро растут в пределах собственной ткани и распространяются на соседние анатомические участки. Проникновение злокачественных клеток в кровоток и лимфу приводит к возникновению вторичных новообразований в других органах. В частности, метастазы меланомы часто обнаруживают в головном мозге и легких. Наличие распространенной опухоли указывает на терминальную стадию болезни и неблагоприятный прогноз.
Диссеминированная меланома может располагаться в разных участках кожи. У мужчин опухоль чаще обнаруживается на коже спины, а у женщин – на поверхности нижних конечностей. На начальных стадиях злокачественного перерождения обычный невус сложно отличить от опухоли, однако постепенно формируются специфические изменения, заметные даже для обывателя. Признаки новообразований внутренних органов могут не отличаться от других форм онкологии.
8 (495) 320-19-03
Круглосуточно без выходных
Частота обнаружения меланобластом может быть связана с климатом и индивидуальными особенностями определенных популяций. Так, возникновению злокачественных опухолей кожи более подвержены люди со светлой кожей. Тем не менее следует учитывать наследственные особенности и другие факторы риска.
Кожа как орган
Кожный покров человека является самым большим по своей протяженности органом. Это своеобразная наружная оболочка, являющаяся границей между внешним пространством и внутренней средой. С точки зрения гистологии кожа разделена на эпидермис, являющийся наружным ороговевшим слоем клеток, дерму и подкожную жировую клетчатку. К производным кожи следует отнести волосы, ногти, сальные, потовые и молочные железы.
Основные функции органа:
- Сохранение тепла в организме.
- Защита внутренних структур от инфекционных агентов, механического и химического воздействия.
- Поглощение кислорода для дыхания и удаление углекислого газа.
- Удаление избытка жидкости, продуктов обмена веществ и минеральных соединений с секретом потовых желез.
- Депонирование крови.
- Поддержание выделительной функции почек.
- Выработка собственного витамина D и некоторых гормональных веществ.
- Обработка ощущений, связанных с внешними воздействиями (рецепторы).
- Поддержание функций иммунной системы.
В коже также содержится большое количество пигментных клеток (меланоцитов), определяющих цвет внешнего покрова человека. Так, цвет кожи зависит от концентрации меланина в клетках. Большое количество меланина связано с лучшей защитой кожи от ультрафиолетового излучения. Люди с бледной кожей, напротив, плохо защищены от УФ-лучей и подвержены риску злокачественного новообразования.
На поверхности кожи практически любого человека есть родинки, представляющие собой доброкачественные опухоли, состоящие из меланоцитов. В зависимости от формы родинки могут быть плоскими, висячими, выпуклыми или круглыми. Средний размер невуса не превышает 1-2 см, однако встречаются и достаточно крупные образования. Диссеминированная меланома часто берет свое начало от родинок, поэтому количество таких образований на коже может быть связано с риском возникновения заболевания.
Причины возникновения
Как и в случае многих других онкологических заболеваний, точные причины возникновения меланомы до сих пор изучаются. Предполагается, что при длительном воздействии патологических факторов нормальные клетки кожи видоизменяются и начинают бесконтрольно делиться, что приводит к росту опухоли. Нормальные клетки имеют ограниченный цикл деления, однако при нарушении ДНК или внутренних систем регуляции возможно возникновение злокачественных клеток.
Существует множество факторов, повреждающих генетическую информацию в клетках. Это ионизирующее излучение, онкогенные химические вещества и механические повреждения. В случае меланобластомы более существенным фактором риска является ультрафиолетовое излучение солнца. Длительное воздействие УФ-лучей провоцирует возникновение генетических мутаций. Также мутации могут передаваться по наследству.
8 (495) 320-19-03
Круглосуточно без выходных
Возможные факторы риска:
- Светлая кожа. Недостаточная концентрация меланина в коже обуславливает слабую защиту от ультрафиолетового излучения.
- Частое возникновение солнечных ожогов и искусственный загар.
- Проживание в климатической зоне с высокой инсоляцией. Для уменьшения воздействия солнечного излучения можно наносить на кожу специальные крема.
- Большое количество родинок на коже. Формирование более 50 невусов обычно связывают с высоким риском злокачественного перерождения меланоцитов. В частности, опасны висячие и выступающие невусы.
- Диссеминированная меланома в семейном анамнезе (особенно у отца или матери).
- Механическое повреждение родинки.
- Нарушение функций иммунной системы, сопровождающееся ослаблением противоопухолевой защиты.
Таким образом, меланобластома является полиэтиологическим заболеванием. При выявлении факторов риска необходимо регулярно проходить обследования.
Симптомы и признаки

Ранние признаки роста меланомы проявляются редко. Заметить формирующуюся опухоль можно только при заметной локализации или при случайном диагностическом обнаружении. Следует учитывать, что новообразования меланоцитов нередко формируются в малозаметных местах.
Признаки патологического невуса:
- Отсутствие симметрии. Обычные родинки круглые и симметричные.
- Нечеткая граница образования. Края здорового невуса резко переходят в кожу.
- Изменение цвета. Особенно важным признаком является появление неравномерной окраски.
- Значительное увеличение.
Другие возможные признаки:
- Выделение крови с каловыми массами при наличии меланобластомы в желудочно-кишечном тракте.
- Зуд в области патологической родинки.
- Нарушение аппетита и потеря веса.
- Депрессия и апатия.
- Постоянная слабость и усталость.
- Неврологическая симптоматика при метастазировании опухоли в головной мозг.
При обнаружении перечисленных симптомов следует незамедлительно обратиться к врачу.
Методы диагностики и лечение
Диагностикой и лечением заболеваний кожи занимаются дерматологи. Во время приема врач спросит пациента о жалобах, изучит анамнестические данные для выявления факторов риска и проведет физикальное обследование. Обычно пациенты уже на приеме показывают подозрительные образования, поэтому общий осмотр помогает обнаружить признаки злокачественного новообразования. Для постановки точного диагноза и назначения лечения необходимы данные инструментальной и лабораторной диагностики.
Специальные методы исследования:
- Дерматоскопия – инструментальный осмотр патологического образования кожи или слизистой оболочки. Система линз ручного устройства дает возможность многократно увеличить область осмотра для более точного обследования. Кроме того, используются цифровые дерматоскопы, способные выводить высокоточные изображение на экран и самостоятельно обнаруживать патологические признаки.
- Биопсия пораженного участка – удаление клеточного материала родинки или слизистой оболочки для последующего гистологического исследования в лаборатории. Процедура может быть осуществлена с помощью различных малоинвазивных методов. Результаты гистологического исследования указывают на наличие аномальных клеток и тип новообразования.
- Полный анализ крови для обнаружения признаков онкологии.
- Ультразвуковое исследование – метод сканирования с помощью высокочастотных звуковых волн. УЗИ используют для диагностики близлежащих лимфатических сосудов, что может быть важно при подозрении на метастазирование опухоли.
- Компьютерная, магнитно-резонансная или позитронно-эмиссионная томография органов – высокоточные методы визуализации, позволяющие получать изображения разных отделов органов. Данные КТ, МРТ и ПЭТ позволяют обнаружить вторичные патологические очаги в отдаленных анатомических структурах.
В зависимости от стадии могут быть применены хирургические и терапевтические методы лечения. Как правило, сначала производится полное удаление патологического очага, после чего врачи назначают химиотерапию и лучевую терапию. На поздних стадиях болезни, когда метастазы возникают в отдаленных органах, чаще назначается паллиативное лечение.
Таким образом, диссеминированная меланома является поздней стадией онкологического заболевания кожи. Важно помнить, что раннее обращение к врачу значительно улучшает прогноз.
8 (495) 320-19-03
Круглосуточно без выходных
Источник
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Диссеминированная меланома кожи является крайне неблагоприятным в прогностическом отношении заболеванием, которому свойственно агрессивное течение и быстрая дальнейшая генерализация опухолевого процесса. Несмотря на значительные достижения лекарственной терапии ряда опухолей, успехи при химиотерапии меланом остаются весьма скромными, о чем свидетельствуют неудовлетворительные и устойчиво низкие показатели выживаемости: медиана продолжительности жизни больных на этапе диссеминации колеблется от 6 до 9 месяцев, 5–летняя выживаемость – менее 5% [20]. Вместе с тем, 5–летняя выживаемость больных, леченных с эффектом, может достигать 33–47%, а полных ремиссий – даже превышать этот рубеж. Данные факты вселяют некоторый оптимизм и указывают на необходимость как совершенствования уже имеющихся терапевтических подходов, так и поиска новых более эффективных методов лекарственного лечения диссеминированной меланомы, основанных на понимании сложных молекулярных и иммунологических механизмов контроля опухолевого роста.
В клинической практике накоплен значительный опыт использования различных препаратов, которые в зависимости от принадлежности к той или иной группе определяют метод системного воздействия при диссеминированной меланоме – химиотерапевтический, иммунотерапевтический и комбинированный химиоиммунотерапевтический. Такое деление в некоторой степени отражает и историю развития системного лечения данного заболевания. В настоящий момент продолжаются споры о том, какой из режимов – химиотерапевтический или химиоиммунотерапевтический, является более предпочтительным в качестве терапии первой линии.
Результаты крупных рандомизированных исследований, которыми мы располагаем к настоящему моменту, пока не позволяют четко высказаться в пользу химиоиммунотерапевтических комбинаций с включением цитокинов (интерферон–a и интерлейкин–2) [11, 16–17,28]. В то же время достоверное увеличение частоты полных и частичных ремиссий в отдельных исследованиях, а иногда и времени до прогрессирования, оставляют надежду на перспективность комбинированного использования химиотерапевтических и иммунотерапевтических режимов.
Таким образом, многие исследователи по–прежнему рассматривают химиотерапию, как основной метод системного лечения диссеминированной меланомы. Эндокринная терапия не имеет самостоятельного значения и считается одним из возможных компонентов вышеперечисленных лекарственных подходов.
Спектр цитостатиков, применяемых как в однокомпонентных, так и в комбинированных химиотерапевтических режимах, в основном представлен алкилирующими агентами (дакарбазин, цисплатин), производными нитрозомочевины (фотемустин, ломустин, кармустин, нидран) и винкаалкалоидами.
Эффективность монотерапии, как правило, не превышает 20–25%. Дакарбазин (DTIC) по–прежнему считается «золотым стандартом» лекарственного лечения диссеминированной меланомы (табл. 1). Средняя продолжительность ремиссий, достигнутых с помощью однокомпонентных режимов, небольшая и, по данным разных авторов, составляет 5–7 мес [4,12,18].
Небольшие успехи монотерапии послужили стимулом к созданию и изучению комбинированных химиотерапевтических режимов на основе дакарбазина. В результате в клиническую практику были введены комбинации DBDT, CVD и BOLD, ставшие популярными в 80–х и начале 90–х годов (табл. 2).
В 1984 г. Del Prete et al. впервые сообщили о высокой эффективности схемы DBDT (дакарбазин, кармустин, цисплатин, тамоксифен) при лечении больных метастатической меланомой. Последующие исследования, проведенные в рамках II фазы, также демонстрировали высокую активность этой комбинации, получившей название «Dartmouth» режим (табл. 3).
По литературным данным эффективность других многокомпонентных режимов (CVD, BOLD, дакарбазин +фотемустин) сопоставима с DBDT, хотя прямого сравнения этих комбинаций между собой не проводилось (табл. 4).
Вместе с тем, методика проведения этих исследований – отсутствие рандомизации, малое число пациентов (в основном с разными прогностическими показателями) – позволила некоторым авторам поставить под сомнение преимущество комбинированной химиотерапии над монотерапией дакарбазином. Известно, что наиболее значимыми параметрами, определяющими прогноз больных меланомой на этапе диссеминации, являются характер метастазирования, исходный соматический статус, время от удаления первичного очага до развития рецидива заболевания и ряд лабораторных показателей (ЛДГ, щелочная фосфататаза и др.). При метастазах в мягкие ткани и/или отдаленные лимфоузлы 5–летняя выживаемость пациентов может достигать 13,5%, в то время как при висцеральных поражениях – 2,5–3,6% [3,22]. Причем наихудший прогноз имеют больные с метастазами в печень, головной мозг и/или кости. Возможно, что преобладание пациентов, входящих в благоприятную прогностическую группу и объясняет высокую эффективность комбинированной химиотерапии в представленных выше исследованиях.
Результаты первого масштабного рандомизированного исследования, в котором проводилось прямое сравнение эффективности комбинации DBDT и дакарбазина, только углубили имеющиеся противоречия в выборе терапии [6]. Частота и продолжительность объективных эффектов, а также общая выживаемость в обеих группах достоверно не отличались. Токсичность была существенно выше при использовании комбинации DBDT. В ходе другого рандомизированного исследования также не удалось доказать превосходство комбинации CVD над монотерапией дакарбазином [5] (табл. 5). Проведенный авторами спустя 7 лет окончательный анализ лишь подтвердил вывод о равной эффективности этих двух режимов [21].
Тем не менее, во многих странах мира комбинации с включением DTIC в качестве химиотерапии первой линии по–прежнему занимают ведущее место в лечении метастатической меланомы. В первую очередь это объясняется желанием врачей задействовать весь арсенал активных при данном заболевании цитостатиков, а также явным дефицитом масштабных рандомизированных исследований, которые убедительно демонстрировали бы отсутствие преимуществ у комбинированных режимов.
На наш взгляд, у больных с хорошим соматическим состоянием предпочтительнее использовать комбинированную химиотерапию, в то время как у ослабленных пациентов с сопутствующей патологией и/или признаками полиорганной недостаточности целесообразно проводить монотерапию дакарбазином.
При выборе лечебной комбинации следует также руководствоваться локализацией метастатического поражения. При наличии метастазов в головной мозг, которые клинически могут выявляться у 8–46% больных диссеминированной меланомой, преимущество имеют комбинации с производными нитрозомочевины, поскольку препараты этой группы способны преодолевать гематоэнцефалический барьер. На данный момент мы располагаем результатами нескольких исследований, демонстрирующих возможности терапии больных меланомой с метастатическим поражением головного мозга. В одном из них монотерапия фотемустином была эффективна в 25% случаев, в другом – не уступала комбинации фотемустин + лучевая терапия по частоте объективных эффектов и показателям выживаемости, хотя время до прогрессирования болезни было достоверно выше в группе больных, получавших комбинированное лечение (табл. 6). Химиотерапевтические режимы с включением фотемустина могут рассматриваться в качестве терапии первой линии при метастазах меланомы в головной мозг.
Много исследований посвящено выяснению роли тамоксифена в лекарственных режимах лечения меланомы. В ранних работах, в которых оценивалась эффективность монотерапии тамоксифеном, была отмечена слабая (менее 5%) противоопухолевая активность этого препарата [30]. В то же время результаты отдельных исследований свидетельствовали, что добавление тамоксифена к цисплатину (DDP) приводит к усилению цитотоксического действия последнего in vitro. Данное наблюдение послужило основанием для изучения роли тамоксифена в составе химиотерапевтических схем и комбинаций. В 1993 г. McClay на небольшой группе больных продемонстрировал возможность преодоления резистентности опухоли к цисплатину после комбинации его с тамоксифеном в дозе 20 мг/сутки. У 3 (16%) из 19 больных, не ответивших на монотерапию цисплатином, простое добавление тамоксифена в схему лечения приводило к развитию частичных ремиссий [26].
В одном из первых рандомизированных исследований комбинация дакарбазин + тамоксифен оказалась эффективнее монотерапии дакарбазином [7]. Причем среди больных, получавших комбинированную терапию, частота ремиссий и показатели выживаемости у женщин были достоверно выше, чем у мужчин, что вероятно и повлияло на результатах лечения данной группы.
В последующих двух рандомизированных исследованиях результаты лечения как мужчин, так и женщин не зависели от присутствия тамоксифена в составе режима «Dartmouth», а монотерапия дакарбазином по эффективности не уступала комбинации дакарбазин + тамоксифен (табл. 7). Соответственно был сделан вывод, что химиотерапевтические схемы с включением тамоксифена не имеют преимуществ.
И все же некоторые исследователи допускают, что у отдельных больных тамоксифен является активным компонентом противоопухолевой терапии, хотя при этом может и не оказывать существенного влияния на конечные результаты химиотерапии.
В конечном итоге, оценивая химиотерапевтические возможности при диссеминированной меланоме, может сложиться достаточно печальное представление о том, что мы так и не смогли добиться выразительных успехов в лечении данного заболевания. Тем не менее, нельзя забывать о наблюдаемых продолжительных ремиссиях у отдельных пациентов. В недавнем ретроспективном анализе результатов терапии больных, получавших режим «Dartmouth», 5–летняя выживаемость при полных ремиссиях достигла 33% (!) [22]. Возможно, что разрабатываемые в настоящее время более специфические иммунотерапевтические подходы (вакцинотерапия, генная терапия) позволят улучшить результаты и таким образом перевести диссеминированную меланому из разряда устойчивых опухолей в чувствительные.
Литература:
1. Булат Ю.В. Современные возможности лекарственного лечения диссеминированной меланомы кожи. Дисс. … докт. мед.наук, 2000, стр. 189–195.
2. Avril MF, Bonneterre J, Cupissol D, et al. Fotemustine plus dacarbazine for malignant melanoma. Eur J Cancer 11, 1992:1807–18811.
3. Barth A., Wanek L., Morton D. Analysis of prognostic factors in 1521 patients with metastatic melanoma. Proc ASCO, 1995:1299.
4. Bleehen N.M., Newlands E.S., Lee S.M. et al. Cancer research campaign phase II trial of temozolomide in metastatic melanoma. – J. Clin. Oncol., 1995, 13, p. 910–913.
5. Buzaid AC, Legha S., Winn R. et al. Cisplatin, Vinblastin and Dacarbazine versus Dacarbazine alone in metastatic melanoma: preliminary results of a phase III Cancer Community Oncology Program (CCOP) trial. Proc ASCO, 1993, 1328.
6. Chapman P., Einhorn LH., Meyers M., et al. A Phase III Multicenter Randomized Trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17, 1999: 2745–2751.
7. Cocconi G., Bella M., Calabresi F. et al. Treatment of metastatic malignant melanoma with dacarbazine plus tamoxifen. – N. Engl. J. Med., 1992, 327, p. 516–523.
8. Del Prete S.A., Maurer L.H., O(Donnell J. et al. Combination chemotherapy with cisplatin, carmustine, dacarbazine and tamoxifen in metastatic melanoma. – Cancer Treat. Rep., 1993, 68, p. 1403–1405.
9. Delaunay M, Mohr P, Mornex F, et al. A randomized phase III trial of fotemustine versus fotemustine combined with whole brain radiation for brain metastases of melanoma. Ninth international congress on anti–cancer treatment, abs.96, 1999.
10. Eton O, East M, et al. Phase I trial of subcutaneous recombinant human IL–2 in patients with metastatic melanoma. Proc Am Soc Clin Oncol, 1999, abst.2053.
11. Eton O, Legha S, Bedikian A, et al. Phase II randomized trial of cisplatin, vinblastine and dacarbazine plus IL–2 and INF versus CVD in patients with metastatic melanoma. Proc ASCO, V19, 2000, 2174 (abst).
12. Falkson C.I., Falkson G., Falkson H.C. Improved results with the addition of interferon alfa–2b to dacarbazine in the treatment of patients with metastatic malignant melanoma. – J.Clin.Oncol., 1991, 9, p.1403–1408.
13. Falkson C.I., Ibrahim J., Kirkwood J. et al. A randomized phase III trial of dacarbazine versus dacarbazine + interferon alfa–2b versus dacarbazine + tamoxifen versus dacarbazine + interferon alfa–2b + tamoxifen in metastatic malignant melanoma: an ECOG trial. J Clin Oncol, 1998, 16: 1743–1751.
14. Hoffman R., Muller I. et al.: Risk and outcome in metastatic malignant melanoma patients receiving DTIC, cisplatin, BCNU and tamoxifen followed by immunotherpy with interleukin–2 and interferon alpha2a. Brit J Cancer V78, 1998: 1076–1080.
15. Jacquillat C, Khayat D, Banzet P. et al. Final report on a french multicenter phase II study of the nitrosourea fotemustine in 153 evaluable patients with disseminated malignant melanoma including patients with cerebral metastases. Cancer 66, 1990:1873–1878.
16. Keilholz U, Cornelis J, Gore M, et al. Dacarbazine, cisplatin and interferon alpha with or without IL–2 in advanced melanoma: interim analysis of EORTC trial 18951. Pr. ASCO, V18, 1999: 2043 (abst).
17. Keilholz U, Goey S, Punt C, et al. Interferon alfa–2a and interleukin–2 with or witout cisplatin in metastatic melanoma: A randomized trial of the EORTC–MCG. J Clin Oncol 15, 1997: 2579–2588.
18. Lattanzi S.C., Tosteson T., Chertoff J. et al. Dacarbazine, cisplatin and carmustine, with or without tamoxifen, for metastatic melanoma: 5–year follow–up. – Melanoma Res, 1995, 5, p. 365–369.
19. Legha S.S., Ring S., Papadopoulos N. et al. A phase II trial of Taxol in metastatic melanoma. Cancer, 1990, 65, p. 2478–2481.
20. Lotze MT, Kirkwood JM. Current Cancer Therapeutics; 2–nd Edit. C Livingstone, 1996, 178–184.
21. Lotze M., Kirkwood J., et al. Cuteneous melanoma in DeVita V.T., Hellman S.A., Rosenberg S.A. (6th eds): Principles and Practice of Oncology, Philadelphia, Lippincott Co., 2001, p. 2012–2069.
22. Manola J, Ibrahim J, Atkins M, et al. Prognostic factors in metastatic melanoma: A pooled analysis of ECOG trials. Proc ASCO, V19, 2000: 2171 (abst).
23. Margolin K., Liu P–Y., Flaherty L. et al. Phase II stud of carmustine, DTIC, cisplatin and tamoxifen in advanced melanoma: a Southwest Oncology Group study. J Clin Oncol V16, 1998: 664–669.
24. Mastrangelo M.J., Bellet R.E., Berd D. Agressive chemotherapy for melanoma, in DeVita V.T., Hellman S.A., Rosenberg S.A. (eds): Principles and Practice of Oncology, Vol. 5(5), Philadelphia, Lippincott Co., 1991, p. 1–11.
25. McClay E.F., Mastrangelo M.J., Berd D. et al. Effective combination chemo/hormonal therapy for malignant melanoma: Experience with three consecutive trials. – Int. J. Cancer, 1992, 50, p. 553–556.
26. McClay E.F., McClay M.E., Albright K.A. et al. Tamoxifen modulation of cisplatin resistance in patients with metastatic melanoma: A biologically important observation. Cancer , 1993, 72, p. 1914–1918.
27. Richards J.M., Gilewski T.A., Ramming et al. Effective chemotherapy for melanoma after treatment with interleukin–2. – Cancer, 1992, 69, p. 427–429.
28. Ridolfi R, Romanini A, Labianca R, et al. Chemotherapy vs. Biochemotherapy: Phase III trial in outpatients with advanced melanoma. Proc ASCO, V20, 2001, 1392 (abst).
29. Ringborg U, Rudenstam C, Hansson J et al. Dacarbazine versus dacarbazine–vindezine in disseminated malignant melanoma: A randomized phase II study. Med. Oncol Tumor Pharmacother 6:285–289, 1989.
30. Rumke P., Kleeberg U.R., MacKie R.M. et al. Tamoxifen as a single agent for advanced melanoma in postmenopausal women. A phase II study of the EORTC malignant melanoma cooperative group. – Melanoma Res., 1992, 2, p. 153–155.
31. Rusthoven J.J., Quirt IC., Iscoe N.A. et al. Randomized, double–blind, placebo–controlled trial comparing the response rates of carmustine, dacarbazine and cisplatin with and without tamoxifen in patients with metastatic melanoma. J. Clin. Oncol., 1996, 14, p. 2083–2090.
32. Saba H.I, Klein C., Reintgen D. Management of advanced stage IV metastatic melanoma with a platinol based combination chemotherapy regiment: A University of South Florida and H. Lee Moffitt Melanoma Center study. Proc. ASCO, 1993, 397a.
33. Schultz M., Buzaid A.C., Poo W.J. A Phase II study of cisplatin, dacarbazine, carmustine, tamoxifen, and interferon–alpha 2B in metastatic melanoma. Melanoma Research 7, 1997: 147–151.
34. Seigler SA, Lucas VS, Pickett NJ et al.: DTIC, CCNU, Bleomycin and Vincristine in metastatic melanoma. Cancer 46, 1980: 2346–2348.
35. York R, Foltz A.: Bleomycine, vincristine, lomustine and DTIC chemotherapy for metastatic melanoma. Cancer 61: 2183–2186, 1989.
Источник
