Впч инфекция бактериальный вагиноз
Бактериальный вагиноз у женщин с папилломавирусной инфекцией гениталий
С.И.Роговская
Научный центр акушерства, гинекологии и перинатологии РАМН (дир. – акад. РАМН В.И.Кулаков), Москва
Полагают, что папилломавирусная инфекция (ПВИ) среди других инфекций генитального тракта, передаваемых половым путем (ИППП), занимает по распространенности одно из первых мест в мире. Известно, что возбудителем ее является ДНК-содержащий вирус папилломы человека (ВПЧ), персистирующий только в эпителиальных тканях [1].
Патологические состояния, ассоциированные с ВПЧ, можно условно разделить на 2 основные группы: клинические формы, характеризующиеся экзофитными разрастаниями кожи и слизистых оболочек (остроконечные кондиломы) и субклинические формы, которые повреждают эпителиальные ткани, не вызывая экзофитного роста, являющиеся чрезвычайно трудными для диагностики (плоские, инвертирующие кондиломы, цервикальные интраэпителиальные неоплазии всех степеней тяжести). Рак шейки матки, одно из наиболее опасных следствий инфицирования высокоонкогенными типами ВПЧ, находится на 2-м месте в структуре онкологической патологии у женщин. Исследования последних лет показали, что ВПЧ часто свойственно длительное течение без выраженной клинической симптоматики, высокая вероятность рецидивирования после лечения и в то же время возможность обратного развития без лечения.
Поэтому, несмотря на значительные успехи медицины в области понимания генеза рака шейки матки, своевременное выявление, лечение и профилактика ПВИ продолжают оставаться чрезвычайно трудной задачей для практических врачей [2]. Одной из причин таких трудностей является частое сочетание ПВИ с другими ИППП, а также возможные нарушения вагинальной микрофлоры, которые снижают эффективность лечения ПВИ и, следовательно, требуют своевременной терапии и коррекции. Предпринимаются попытки их терапии с помощью самых различных препаратов, однако их недостаточный эффект и высокая частота рецидивирования заставляют искать новые средства, которые могли бы быть более эффективными, не нарушать микроэкологию, а, наоборот, восстанавливать ее, тем самым помогая иммунной системе женщины справиться с вирусной инфекций. Поэтому лечение сопутствующих инфекций и коррекция микробиоценоза влагалища сегодня рассматривают как один из необходимых этапов лечения ПВИ гениталий и профилактики ее рецидивов.
В научно-поликлиническом отделении Научного центра акушерства, гинекологии и перинатологии РАМН накоплен определенный опыт ведения пациенток с ПВИ генитального тракта. С целью выяснения частоты сочетания ПВИ с другими ИППП, а также определения влияния бактериального вагиноза (БВ) на течение данной инфекции и эффективность ее лечения нами был проведен анализ наблюдений за 84 женщинами-носителями ВПЧ с различными проявлениями ПВИ.
Для диагностики ПВИ и других инфекций были использованы современные методы: полимеразная цепная реакция (ПЦР), цитологический и гистологический методы, бактериоскопия вагинального мазка, окрашенного по Граму, бактериологический метод с посевами на специальные среды. Терапию заболеваний, обусловленных ВПЧ, подбирали индивидуально после проведения лечения сопутствующих ИППП и коррекции вагинальной микрофлоры.
С помощью метода ПЦР, бактериоскопии вагинальных мазков и некоторых других специальных тестов были выявлены: микоплазмы – у 19 (22,6 %) женщин, уреаплазмы – у 16 (19%), хламидии – у 11 (13,1%), цитомегаловирус – у 11 (13,1%), вирус герпеса – у 12 (14%), кандидоз – у 21 (25%) женщины, БВ – у 26 (30,9%) из 93 обследованных пациенток. Учитывая наличие ассоциаций инфекционных агентов друг с другом, общее число женщин с наличием тех или иных сопутствующих возбудителей на фоне ПВИ составило 56 (66,7%) из 84 обследованных.
Таким образом, еще раз было подтверждено, что ПВИ гениталий чаще встречается в виде полиинфекции, которая, как правило, требует соответствующей диагностики и терапии.
Более детальное изучение состояния вагинальной микроэкологии у 50 пациенток с ПВИ выявило у 44 % женщин нарушения микроценоза влагалища, в большинстве случаев связанные с пролиферацией условно-патогенной микрофлоры (УПМ) факультативно и облигатно анаэробного происхождения на фоне элиминации или резкого снижения содержания лактобактерий. Полученные данные представлены в табл. 1
Таблица 1. Состояния вагинального микроценоза у пациенток с ПВИ
| Состояние микроэкологии влагалища | Число пациенток (n=50) | |
| Нормоценоз | 28 | 56 |
| БВ | 10 | 20 |
| Вагинальный кандидоз | 5 | 10 |
| Неспецифический вагинит | 2 | 4 |
| Дисбиоз иного происхождения | 5 | 10 |
| Всего… | 50 | 100 |
При этом только у 28 % женщин с нормоценозом микроэкология полностью соответствовала критериям нормы репродуктивного возраста: у остальных имелись те или иные отклонения, связанные либо с выраженной лейкоцитарной реакцией, либо с недостаточным титром лактобацилл, либо с нарастанием титра факультативно анаэробных УПМ на фоне высокого содержания лактобактерий. Наиболее часто, по данным бактериоскопии, при ПВИ был диагностирован БВ.
Известно, что нормальная вагинальная микроэкосистема характеризуется доминированием лактобацилл, вагинальным эпителием, поверхностные слои которого насыщены гликогеном, отсутствием лейкоцитарной воспалительной реакции. При БВ нарушается установившееся равновесие, снижается концентрация лактобацилл, повышается количество анаэробной и грамотрицательной флоры, в частности Gardnerella Vaginalis, Mycoplasma Hominis, Mobiluncus spp и др. [3].
Поскольку микроорганизмы, ассоциированные с БВ, не изменяют структуру влагалища настолько, чтобы вызвать ответную лейкоцитарную реакцию, данный синдром большинство авторов расценивают не как инфекционный, а как экологический дисбаланс. Крупные эпидемиологические исследования последних лет показали, что у женщин с нарушенной экосистемой влагалища чаще развиваются осложнения беременности и родов, повышается риск развития СПИДа и других инфекций, включая также ПВИ гениталий. Так, было показано, что нарушение в локальной иммунной системе, характеризующееся изменениями в выработке цитокинов, в частности, 1-бета-интерлейкинов, туморнекротизирующего фактора и др., выявляется как при БВ, так и при ПВИ [4].
Колонизирующие слизистую оболочку влагалища лактобациллы активно участвуют в обеспечении экологического барьера прежде всего за счет кислотообразования и продукции перекиси водорода, формируя и поддерживая кислую реакцию влагалища (pH 3,8–4,5). При этом молочная кислота метаболизируется лактобактериями в процессе деструкции гликогена, содержащегося в эпителиальных клетках. БВ характеризуется снижением количества пероксидпродуцирующих молочно-кислых бактерий и повышением количества других видов микроорганизмов. При этом процесс выработки молочной кислоты нарушается, формируется щелочная среда, происходит диссеминирование анаэробной флоры.
В настоящее время признано, что диагностика БВ должна основываться на 4 ведущих критериях: наличие жидких сероватых белей, повышение pH более 4,5–4,7, положительный аминный тест (появление или усиление запаха “гнилой рыбы” при смешивании влагалищного содержимого с 10% гидроокисью калия – КОН), появление в мазках характерных “ключевых клеток”, которые представляют собой эпителиальные клетки с адгезированными на них микроорганизмами. Считается, что для правомочности постановки диагноза достаточно 3 из перечисленных признаков [5].
Терапия БВ остается нелегкой задачей ввиду частого рецидивирования или низкой эффективности ряда предложенных препаратов. Многочисленные работы последних лет свидетельстуют о том, что основными препаратами выбора в настоящее время считаются метронидазол и клиндамицин, которые обладают антианаэробными свойствами [6].
Метранидазол, который представляет собой антибактериальный препарат, содержащий имидазольное кольцо, широко применяется в различных схемах, причем описана эффективность препарата как при разовых схемах в дозе 2 г, так и при 5–7-дневных курсах лечения. Однако пероральные формы препарата способны вызвать иногда побочные реакции, ограничивающие его использование.
Среди местных форм лечения широкое применение при БВ нашел клиндамицин – антибиотик группы линкозамидов. Известно, что он обладает выраженной антибактериальной активностью, подавляя синтез белка в микробной клетке, взаимодействуя с 50S-субъединицами рибосом. Клиндамицин оказывает бактериостатическое действие, а в более высоких концентрациях в отношении некоторых микроорганизмов – бактерицидное. Препарат активен в отношении микроорганизмов, вызывающих вагинозы: Gardnerella vaginalis, Mobiluncus spp., Bacteroides spp., Peptostreptococcus spp. He активен в отношении Trichomonas vaginalis и Candida albicans.
Клиндамицин применяют как перорально, так и местно внутривлагалищно в виде кремов и овулей, причем для лечения БВ местное лечение является предпочтительным, поскольку за счет минимальной системной абсорбции (только 4% препарата резорбируется в системный кровоток) практически не вызывает побочных реакций. Среди неблагоприятных эффектов описаны аллергические реакции, рост дрожжеподобных грибов, поэтому некоторые авторы рекомендуют дополнительно к лечению клиндамицином добавлять антимикотики.
Несколько крупных рандомизированных плацебо-контролируемых исследований позволили установить высокую эффективность как 7-, так и 3-дневного курса лечения вагинальным кремом клиндамицина [6, 7].
Для лечения бактериального вагиноза у женщин с ПВИ мы применяли 2% далацин Ц – вагинальный крем, содержащий 100 мг клиндамицина фосфата, по стандартной 3-дневной схеме. Критерии наличия БВ устанавливали с помощью стандартных тестов (как минимум 3 признака из 4 указанных выше).
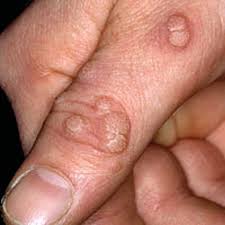
Под наблюдением находилось 22 пациентки с остроконечными и плоскими кондиломами влагалищной стенки и шейки матки, из которых 15 (68,2%) являлись носителями высокоонкогенных ВПЧ типов 16, 18, включая 6 (27,3%) женщин с сочетанием различных типов. У 7 (31,8%) пациенток были выявлены низкоонкогенные типы 6 и 11. У всех 22 женщин был обнаружен БВ, по поводу которого был рекомендован далацин Ц ежедневно однократно внутривлагалищно. В течение первой недели после окончания курса лечения пациентки подвергались контрольному осмотру. Было отмечено, что полная санация на основании перечисленных признаков наблюдалась у 17 (77,3%) женщин, у 4 (18,2%) – имелся частичный эффект, у 1 (4,5%) –эффект отсутствовал. При этом было отмечено, что после применения далацина у 4 (18,2%) пациенток развился кандидоз, по поводу чего было назначено соответствующее лечение антимикотическими препаратами. Тем пациенткам, у которых лечение было неэффективным, были рекомендованы другие средства. При частичном эффекте рекомендовали повторный курс терапии далацином. Затем для восстановления нормальной микрофлоры всем женщинам был назначен эубиотик ацилакт внутривлагалищно по 1 свече в течение 10 дней после получения отрицательных результатов исследования на грибы. Лечение заболеваний гениталий, обусловленных папилломавирусом, проводилось по индивидуальным схемам после полного курса лечения БВ.
Для коагуляции остроконечных кондилом влагалища применяли преимущественно солкодерм по 1 аппликации 1 раз в неделю, для лечения патологии шейки матки – лазервапоризацию. Эффективность лечения ПВИ в данной группе женщин сравнивали с эффективностью аналогичной терапии у 14 пациенток с ПВИ и БВ без предварительной терапии БВ и коррекции микробиоценоза, которые составили контрольную группу. Было отмечено, что эпителизация шейки матки после лазервапоризации происходила более быстрыми темпами у женщин после лечения далацином, при этом через 1 мес после процедуры участки аномального эпителия на шейке матки были обнаружены у 1 (4,5%) пациентки этой группы и у 3 (21%) пациенток контрольной группы, что свидетельствует о необходимости лечения БВ перед деструкцией очагов ПВИ, так как правильная подготовка больных к этим процедурам способствует более качественной и быстрой эпителизации тканей.
Таким образом, накопленный опыт показывает, что у большинства пациенток ПВИ сочетается с другими инфекциями нижних отделов гениталий. Патология влагалища может быть обусловлена БВ, вагинальным кандидозом, неспецифическим вагинитом и другими проявлениями вагинального дисбиоза, среди которых БВ занимает ведущее место. Полученные результаты свидетельствуют о целесообразности проведения микробиологического обследования пациенток с ПВИ влагалища и шейки матки, что позволяет в случае необходимости провести соответствующее лечение перед назначением терапии ПВИ гениталий, избежать возможных инфекционных осложнений и повысить эффективность лечения ПВИ. Препарат “Далацин Ц” является эффективным для лечения БВ у женщин с ПВИ гениталий.
Литература
1. Gross G, Borasso R. Human Papillomavirus Infection.Atlas. Berlin/Wiesbaden, Ulsein Mosby, 1997.
2. Tabrisi SN. et al. Br Obst & Gyn 1999; 106: 252-7.
3. Заболевания шейки матки, влагалища и вульвы. Под ред. проф. В.Н.Прилепской М.: Медпресс, 2000.
4. Sharon L. Hiller. New Z Fam Physician 1998; 57 (12): 2616.
5. Анкирская А.С., Прилепская В.Н., Байрамова Г.Р., Муравьева В.В. РМЖ 1998; 6 (5): 276-82.
6. Joesoef MR, Schmid GP. Clin Infect Dis 1995 Apr; 20 (Suppl 1): 72-9.
7. Porozanova V. Bozanova S. Arush Ginekol (Sofia). 2000; 39(2): 34-5.
Источник
Среди вирусных инфекций, поражающих аногенитальную область, наиболее распространена папилломавирусная инфекция (ПВИ), вызываемая вирусом папилломы человека (ВПЧ). Частота встречаемости одного из проявлений ПВИ — аногенитальных бородавок (остроконечных кондилом) — составляет 19,1%, а инфицированность урогенитального тракта ВПЧ среди лиц молодого и среднего возраста в некоторых популяциях достигает 34,4–44,9% [10]. ВПЧ — ДНК-содержащий вирус, персистирующий только в эпителиальных тканях. Патологические состояния, ассоциированные с ВПЧ, можно условно разделить на две основные группы: клинические формы, характеризующиеся экзофитными разрастаниями кожи и слизистых оболочек (остроконечные кондиломы), и субклинические формы, которые повреждают эпителиальные ткани, не вызывая экзофитного роста, но являющиеся чрезвычайно трудными для диагностики (плоские, инвертирующие кондиломы, цервикальные интраэпителиальные неоплазии всех степеней тяжести). ПВИ часто свойственно длительное течение без выраженной клинической симптоматики, высокая вероятность рецидивирования после лечения, а также возможность обратного развития без лечения [8].
ВПЧ имеет специальные механизмы, подавляющие как клеточный, так и гуморальный иммунитет, в частности интерфероновое звено иммунной системы [15]. Поэтому при ПВИ закономерно развиваются вторичные иммунодефициты, обусловленные недостаточностью разных звеньев иммунной системы. ВПЧ не инфицируют антиген-представляющие клетки, что является причиной отсутствия прямого пути активации системы иммунитета при ПВИ. Длительной персистенции ВПЧ способствует способность вируса «ускользать» от системного иммунного надзора. Хотя ВПЧ инфицирует преимущественно базальные клетки, репликация вируса и сборка вирусных частиц происходит в дифференцированных клетках поверхностного слоя эпителия, которые подвергаются последующему апоптозу, поэтому вышеуказанный процесс не сопровождается признаками воспаления, а иммунная система его практически игнорирует (эписомальная форма) [17]. Интегративная форма папилломавирусной инфекции обнаруживает снижение концентрации интерферонов альфа (ИФН-α), интерферонов гамма (ИФН-γ), интерлейкина-18 (ИЛ-18), а также локальную иммуносупрессию — повышение значений интерлейкина-10 (ИЛ-10) [1]. Ключевую роль в рецидивировании ПВИ играют локальные иммунные процессы, а именно цитокиновая регуляция локального иммунного ответа на ВПЧ. У женщин с ПВИ, имеющих морфологические изменения эпителия шейки матки или другую гинекологическую патологию, обнаружено выраженное снижение уровней ИНФ-α и фактора некроза опухолей альфа (ФНО-α), повышение концентраций ИНФ-γ, ИЛ-10 и повышение уровня секреторного иммуноглобулина А (sIgА) в цервикальной слизи. Избыток ИЛ-10 ведет к снижению противоинфекционной защиты и развитию хронических инфекций. ИЛ-10 также способствует стимуляции опухолевого роста в результате ингибирования T-клеточного иммунного ответа [7].
Cвоевременное выявление, лечение и профилактика данной инфекции продолжают оставаться чрезвычайно сложной задачей для практических врачей. Одной из причин этого является частое сочетание ПВИ с другими инфекциями, передающимися половым путем (ИППП), требующими терапии, а также возможные нарушения вагинальной микрофлоры, которые снижают эффективность лечения вирусной инфекции, а поэтому требуют своевременного их выявления и коррекции [9].
ПВИ может манифестировать как моноинфекция, однако многочисленные данные литературы свидетельствуют о том, что в наиболее тяжелой форме она протекает у женщин, инфицированных другими возбудителями, ввиду еще большего повышения пролиферативной активности эпителия. Большинство случаев рецидивов ПВИ связывают с провоцированием их другими ИППП, и как микст-инфекция выявляется в 71% случаев. При этом с генитальным кандидозом ПВИ сочетается в 33,3%, генитальным герпесом и цитомегаловирусной инфекцией — в 37%, хламидийной и микоплазменной инфекцией — в 46,3% и наиболее часто с бактериальным вагинозом (БВ) — в 66,7% случаев [6, 9].
Бактериальный вагиноз остается одной из самых распространенных патологий в акушерско-гинекологической практике и занимает 30–50% от общей заболеваемости вульвовагинальными инфекциями. БВ сопровождается усиленным ростом преимущественно облигатно анаэробных бактерий и резким снижением концентрации лактобактерий. Основную роль в возникновении БВ отводят нарушениям биоценоза влагалища, и к одному из эндогенных факторов относят нарушения общего и местного иммунитета. При БВ имеются нарушения в системе местного иммунитета (уменьшение концентрации IgA, sIgA, IgG и увеличение концентрации IgM, дисфункция нейтрофилов вагинального содержимого). Нарушения в системе общего иммунитета заметны лишь при длительно текущем заболевании (более 5 лет) [5].
При влагалищном дисбиозе на эпителий шейки матки воздействуют нитрозамины, выделяющиеся в процессе жизнедеятельности анаэробных бактерий, вызывающие патологические изменения в тканях. Кроме того, влагалищный дисбиоз и ВПЧ ведут к снижению выработки sIgA, что также способствует персистенции ВПЧ, увеличению площади атипичного со сниженной концентрацией гликогена эпителия шейки. Это еще больше снижает секрецию sIgA и усугубляет влагалищный дисбиоз. При хроническом цервикальном воспалении происходит миграция натуральных киллеров и фагоцитов, которые высвобождают медиаторы воспаления, ассоциированные с дисплазией и раком шейки матки, а также происходит повышенная продукция антимикробных оксидантов, которые могут вызвать окислительные повреждения ДНК хозяина [4].
Развитию БВ способствуют изменения уровня гормонов, нарушение микробиоценоза кишечника и иммунного статуса, предшествующая терапия антибиотиками, перенесенные в прошлом другие инфекции мочеполового тракта, применение иммунодепрессантов или гормональных средств, частая смена половых партнеров. Схожие факторы обнаруживаются при анализе анамнеза пациенток с ПВИ [9].
Согласно существующим принципам ведения больных с клиническими проявлениями, связанными с ВПЧ, лечение должно быть направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса, на стимуляцию противовирусного иммунного ответа, а также на сочетание этих подходов [2, 11].
С учетом вирусного характера заболевания основными иммунными препаратами, которые используют для терапии остроконечных кондилом, являются препараты интерферона (ИФН). Применение ИФН в очагах поражения снижает количество вирусной ДНК, что коррелирует с клиническим улучшением или исчезновением поражений [13, 14].
Внутриочаговое применение препаратов ИФН-α и ИФН-β приводит к исчезновению 35–63% бородавок, причем как уже леченных, так и не леченных ранее [16].
На российском рынке представлен широкий выбор препаратов ИФН отечественных и зарубежных производителей. В связи с большей, по сравнению с человеческими ИФН, стойкостью рекомбинантных ИФН (рекомбинантный ИФН-α-2b, рекомбинантный ИФН-α-2а, очищенный ИФН-α-n1), им отдается предпочтение в практическом применении [10].
Терапия БВ также остается нелегкой задачей ввиду частого рецидивирования или низкой эффективности препаратов.
Сочетание ПВИ с БВ и, как следствие, нарушение вагинальной микрофлоры, снижающее эффективность лечения ПВИ, требуют своевременной терапии и коррекции. Своевременная коррекция микробиоценоза влагалища при ПВИ с дополнительным применением препаратов иммуномодулирующего действия положительно влияет на течение папилломавирусной инфекции у женщин.
Для лечения БВ применяются методы местной и системной терапии. Основными препаратами для лечения БВ являются метронидазол, клиндамицин и тинидазол, которые применяют как в таблетированной форме для приема внутрь, так и в виде местных форм. Метронидазол назначают в дозе 500 мг 3 раза в день в течение 7 дней или однократно в дозе 2 г [12].
Учитывая наличие местного иммунодефицита у больных ПВИ, ассоциированной с БВ, перспективно системное лечение с использованием иммуномодуляторов для интравагинального применения. Существенное увеличение уровня ИФН-α — важный элемент снижения вероятности рецидивов и восстановления противовирусного иммунитета [3].
Учитывая важность иммунитета как фактора риска возникновения БВ и персистенции ПВИ, целью настоящего исследования служила оптимизация терапии ПВИ, ассоциированной с БВ, за счет местной иммуномодулирующей терапии в комплексе с системной коррекцией влагалищного микробиоценоза.
Материал и методы исследования
Под наблюдением находились 44 пациентки с остроконечными и плоскими кондиломами влагалищной стенки и шейки матки, из которых 30 (68,2%) являлись носителями высокоонкогенных ВПЧ 16-го, 18-го типов, включая 12 (27,3%) женщин с их сочетанием. У 14 (31,8%) пациенток были выявлены низкоонкогенные типы 6 и 11. У всех женщин был выявлен БВ.
Всем пациенткам было назначено лечение: интравагинальное введение суппозиториев Генферон® по 1 млн МЕ 2 раза в день в течение 10 дней (для лечения ПВИ) и метронидазол по 500 мг внутрь 3 раза в день в течение 7 дней (для лечения БВ). Деструктивные методы лечения ПВИ не применялись.
Эффективность лечения оценивали по результатам исследования влагалищного микробиоценоза до лечения, через 2 недели, 6 и 12 месяцев после окончания лечения и дополнительно — по результатам РАР-мазков (тест Папаниколау) и ВПЧ-тестирования (полимеразная цепная реакция) (через 6 и 12 месяцев). Кроме того, определяли концентрацию ИЛ-10 и ФНО-α в вагинально-цервикальном смыве через 6 месяцев после лечения.
Результаты обрабатывали статистически с использованием непараметрических критериев: U-критерия Манна–Уитни. Различия принимались достоверными при р < 0,05.
Результаты исследования и обсуждение
Результаты исследования показали, что нормализация влагалищного микробиоценоза произошла у всех женщин через 2 недели после лечения. Через 6 и 12 месяцев в шейке матки ДНК ВПЧ не определялась у 36 пациенток (81,8%) и у 4 пациенток (9,1%). При наблюдении в течение 12 месяцев у пациенток элиминация ВПЧ произошла у 40 пациенток (90,9% случаев), рецидивов БВ не было. Применение Генферон® и метронидазола позволило нормализовать концентрацию цитокинов в вагинально-цервикальном смыве (табл.).
Лечение БВ метронидазолом обосновано стандартами с учетом международных рекомендаций Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC). Метронидазол — антибактериальный препарат, широко применяется в практике лечения БВ, обладает быстрореализующимся противовоспалительным действием при отсутствии побочных эффектов на местный и общий иммунитет. Это является важным положительным свойством препарата при лечении генитальной вирусной инфекции.
Генферон® обладает иммуномодулирующим, противовирусным, опосредованным антибактериальным, местноанестезирующим, регенерирующим действием. Комбинированное действие Генферона® обусловлено компонентами в его составе, которые оказывают местное и системное действие. В состав Генферона® входит человеческий рекомбинантный интерферон альфа-2b. Он синтезируется генно-инженерно-модифицированным штаммом микроорганизма Escherichia coli. Интерферон альфа-2b является иммуномодулятором, а также оказывает антипролиферативное, антивирусное и антибактериальное действие. Эти эффекты вызваны стимулирующим действием препарата на внутриклеточные ферменты, которые ингибируют воспроизводство вируса. Интерферон усиливает клеточный иммунитет посредством активации ряда маркеров клеток-киллеров, ускорения деления B-лимфоцитов и синтеза ими антител, увеличения активности моноцитарно-макрофагальной системы и повышения распознаваемости зараженных и опухолевых клеток. В результате этого повышается эффективность борьбы организма с вирусами, бактериями, паразитами и раковыми клетками. Также под воздействием интерферона происходит активация лейкоцитов слизистой оболочки, которые участвуют в подавлении патологических очагов. Таурин нормализует метаболические процессы в тканях, способствует их регенерации, взаимодействует со свободными радикалами кислорода, нейтрализуя их и предохраняя ткани от повреждения. Интерферон менее подвержен распаду и дольше сохраняет свое действие благодаря присутствию таурина. Бензокаин (Анестезин) — местное обезболивающее средство. Он изменяет проницаемость цитоплазмы нейронов для ионов натрия и кальция, в результате чего не только блокируется проведение нервных импульсов по аксонам, но и ингибируется сам процесс возникновения нервных импульсов. Бензокаин обладает только местным эффектом и не всасывается в системный кровоток.
При вагинальном применении, благодаря большой концентрации препарата в очаге инфекции и его закреплении на клетках слизистых, достигается заметный местный терапевтический эффект. Препарат разрешен к применению у взрослых людей в соответствии с инструкцией в составе комплексной терапии при инфекционно-воспалительных заболеваниях урогенитального тракта (генитальный герпес, хламидиоз, уреаплазмоз, микоплазмоз, рецидивирующий вагинальный кандидоз, гарднереллез, трихомониаз, папилломавирусная инфекция, бактериальный вагиноз, эрозия шейки матки, цервицит, вульвовагинит, бартолинит, аднексит, простатит, уретрит, баланит, баланопостит).
Заключение
Результаты проведенного исследования обосновали этиопатогенетическую терапию больных с папилломавирусной инфекцией, ассоциированной с бактериальным вагинозом, местным использованием препарата Генферон® в комплексе с системным препаратом метронидазол. Практическое использование данной схемы лечения обеспечивает у большинства пациенток достижение стойкого клинического эффекта, элиминацию ВПЧ и профилактику рецидивов ПВИ и БВ. Иммунопатологические механизмы развития ПВИ и БВ объясняют высокую эффективность комплексного применения местной и системной терапии больных с ПВИ, ассоциированной с БВ.
Литература
- Андосова Л. Д. Состояние локального иммунитета в зависимости от тяжести плоскоклеточного интраэпителиального поражения шейки матки // Медицинский альманах. 2013. № 6 (30). С. 66–69.
- Ведение больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями: Клинические рекомендации РОДВ. Издательский дом «Деловой экспресс», 2012. 112 с.
- Летяева О. И., Абрамовских О. С., Гизингер О. А. Оппортунистические инфекции гениталий и папилломавирусная инфекция: новые возможности иммуномодулирующей терапии // Акушерство и гинекология. 2011. № 6. С. 108–112.
- Манухин И. Б., Крапошина Т. П., Григорян С. Н. Показатели эндотоксинемии, антиэндотоксинового иммунитета и вирусной нагрузки у пациенток с вульварной интра-эпителиальной неоплазией I степени, ассоциированной с вирусом папилломы человека // Врач скорой помощи. 2012. № 2. С. 51–55.
- Олина А. А., Падруль В. М. Папилломавирусная инфекция гениталий и бактериальный вагиноз // Фарматека. 2007. № 1. С. 49–54.
- Прилепская В. Н., Роговская С. И. Возможности Изопринозина в лечении хронических цервицитов и вагинитов // Российский медицинских журнал. 2007. Т. 16, № 3. С. 5–9.
- Прилепская В. Н., Довлетханова Э. Р. Папилломавирусная инфекция — от ранней диагностики к рациональной терапии // Акушерство и гинекология. 2013. № 2. С. 101–107.
- Роговская С. И., Теребнева Л. А. Клинические аспекты плоскоклеточных интраэпителиальных поражений низкой степени // Акушерство и гинекология. 2013. № 2. С. 139–143.
- Роговская С. И. Папилломавирусная инфекция у женщин и патология шейки матки: в помощь практикующему врачу. М.: ГЭОТАР-Медиа, 2008. 192 с.
- Соловьев А. М., Чернова Н. И. Фармакотерапия рецидивирующих клинических проявлений генитальной папилломавирусной инфекции // Российский медицинский журнал. 2015. № 11. С. 621–625.
- Федеральные клинические рекомендации по ведению больных аногенитальными (венерическими) бородавками. М.: РОДВ, 2015. 14 с.
- Шперлинг Н. В., Венгеровский А. И., Шперлинг И. А. Оптимизация системной терапии больных с бактериальным вагинозом // Российский вестник акушера-гинеколога. 2014. Т. 14. № 6. С. 103–107.
- Arany I., Nagamani K., Tyring S. K. Interferon resistance is independent from copy numbers in benign HPV-induced lesions // Anticancer. Res. 1995. Vol. 15, № 3. P. 1003–1006.
- Arany I., Goel A., Tyring S. K. Interferon response depends on viral transcription in human papillomavinus-contaning lesions // Anticancer Res. 1995. Vol. 15. P. 2865–2869.
- Cusini M., Salmaso F., Zerboni R., Carminati G., Vernaci C., Franchi C., Locatelli A., Alessi E. 5% imiquimod cream for external anogenital warts in HIV-infected patients under HAART therapy // Int. J. Std. Aids. 2004. Vol. 15. Р. 17–20.
- Dinsmore W., Jordan J., O’Mahony C., Harris J. R., McMillan A., Radcliffe K. W., Engrand P., Jackson B. W., Galazka A. R., Abdul-Ahad A. K., Illingworth J. M. Recombinant human interferon-beta in the treatment of condylomata acuminate // Int. J. STD. AIDS. 1997. Vol. 8 (10). Р. 622–629.
- Ocnishi H., Kosuzume H., Inaba H. et al. Mehanizm of host defens suppression induced by viral infection: mode of action of Inosimplex as an antiviral agent // Infect. Immun. 1982. Vol. 38 (1). P. 245–250.
Н. В. Шперлинг, доктор медицинских наук, профессор
НОУ ВПО «Медицинский институт «РЕАВИЗ», Санкт-Петербург
Контактная информация: shperling2@yandex.ru
Купить номер с этой статьей в pdf
Источник