Пцр в реальном времени с типированием на впч
Вирус папилломы человека (ВПЧ) – распространенное заболевание, протекание которого носит хронический характер и чревато рецидивами. Полимеразная цепная реакция (ПЦР) – один из самых современных способов диагностики папилломавируса. Этот способ считается надежным и позволяет выявить не только наличие вируса в организме, но также его тип и количество. ПЦР чувствителен даже к неактивной форме вируса, при которой отсутствуют внешние проявления в виде папиллом и кондилом.
Общие сведения
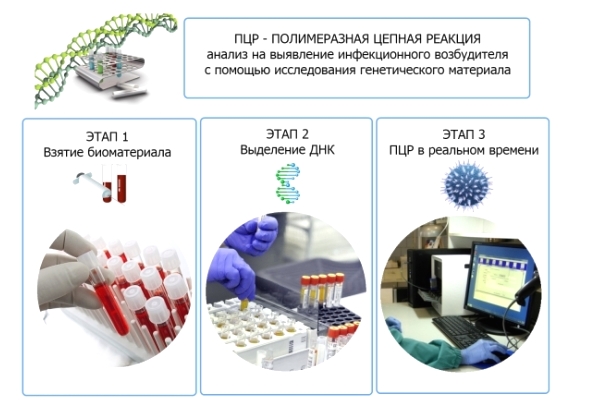 Анализ строится на исследовании ДНК пациента с целью обнаружения в ней присутствия чужеродных элементов. Любая ДНК строится на основе четырех нуклеотидов, располагающихся в определенной последовательности. Когда в организм попадает вирус, происходит изменение порядка в этой цепи, что позволяет оперативно отследить деятельность даже незначительных инородных частиц. Метод ПЦР диагностики проводится с использованием вирусных частиц, что обусловливает быстрое деление клеток.
Анализ строится на исследовании ДНК пациента с целью обнаружения в ней присутствия чужеродных элементов. Любая ДНК строится на основе четырех нуклеотидов, располагающихся в определенной последовательности. Когда в организм попадает вирус, происходит изменение порядка в этой цепи, что позволяет оперативно отследить деятельность даже незначительных инородных частиц. Метод ПЦР диагностики проводится с использованием вирусных частиц, что обусловливает быстрое деление клеток.
Такая диагностика способна отследить активность ВПЧ не только в момент его протекания в скрытой фазе, но и в инкубационный период, когда папилломавирус еще не успел заявить о себе. ПЦР позволяет выявить:
- наличие ВПЧ;
- штаммы, которыми инфицирован больной;
- количественное содержание вируса в организме.
Большинство людей инфицированы папилломавирусом, однако сильный иммунитет подавляет его проявления и не дает размножаться. Поэтому обнаружение ВПЧ качественным методом может быть не всегда оправдано. Это не рационально в случае, если вирус присутствует в организме, но его воздействие минимально и никак не вредит человеку. Тем не менее качественный анализ покажет положительный результат, чем может вести пациента в замешательство.
Поэтому для диагностики чаще всего применяют количественный метод, позволяющий отследить количество вируса в организме и определить, насколько опасна его деятельность. Кроме того, важно установить штамм ВПЧ. Они делятся по степени онкогенности: одни совершенно безопасны и способны вызывать только косметические проблемы, другие могут стать причиной возникновения рака.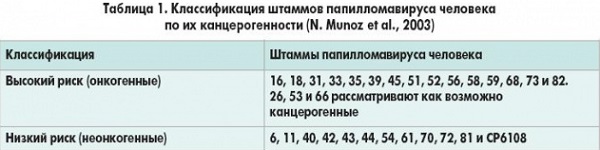
Каждая ситуация требует индивидуального подхода, поэтому прежде чем сдавать анализ, желательно проконсультироваться с врачом. Он подскажет, каким методом и на какие штаммы лучше всего проверяться, исходя из состояния пациента.
Показания для анализа
Инфицирование ВПЧ возможно только при непосредственном контакте с зараженным человеком. Вирус попадает в кровь и начинает размножение в области верхних слоев кожи, что обусловливает появление его характерных признаков – возникновение папиллом и кондилом. 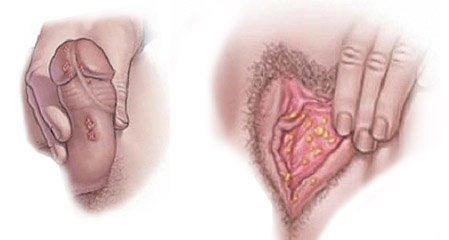 ВПЧ распространяется следующими путями:
ВПЧ распространяется следующими путями:
- при незащищенных половых контактах;
- при естественных родах от инфицированной матери к ребенку;
- контактно-бытовым путем через предметы общего пользования, личные вещи, одежду и т.д.;
- во время тесного контакта с кожей больного.
Чаще всего диагностировать ВПЧ приходят люди, у которых видны внешние признаки болезни. Однако если они никак не проявляются, это не является гарантией отсутствия вируса. Он также может присутствовать в крови и развиваться бессимптомно. Это особенно характерно для высокоонкогенных типов вируса: 16 и 18 штамма, которые провоцируют возникновение рака. Направление на диагностику этих типов обычно происходит при обращении к профильным специалистам: гинекологу и урологу. 
Преимущества метода
ПЦР считается одним из главных методов диагностики и остается самым востребованным среди врачей. Он используется не только для выявления ВПЧ, но также помогает обнаруживать другие заболевания, передающиеся половым путем, гепатиты, скрытые инфекции и т.д. ПЦР диагностика обладает рядом преимуществ по сравнению с другими методами выявления заболеваний. Среди них:
- Высокая специфичность. Тест помогает с большой вероятностью отделить следы чужеродной ДНК от ДНК человека в рамках собранного материала.
- Высокая производительность. ПЦР представляет собой автоматизированный процесс, помогающий провести диагностику непосредственно в день сдачи анализа. Такая скорость исследования позволяет пациенту не волноваться о результате на протяжении долгого времени и получить результат уже через несколько дней.
- Возможность сделать сразу несколько анализов. На основании одного собранного образца можно провести диагностику для выявления нескольких заболеваний. Например, одновременно можно выявить возбудителя хламидиоза и гонореи. При этом такая процедура не сможет отрицательно повлиять на достоверность результата.
- Высокая чувствительность. Тест позволяет обнаружить деятельность вируса даже в инкубационный период, когда его концентрация очень мало. Это поможет предупредить развитие патологического процесса и начать своевременное лечение.
Недостатки метода
Существуют, однако, и некоторые отрицательные моменты в проведении ПЦР диагностики. Главный из них – возможность получения ложноположительного результата. Это происходит в случае, если лечение уже проведено, инфекция побеждена, но мертвые клетки еще остаются внутри тканей. Для обновления клеток необходимо время.
Если провести анализ раньше 2-3 месяцев, ПЦР может показать положительный результат, в действительности принимая уже мертвые клетки за живые. Метод не делает различий между ними, он нацелен на поиск ДНК вируса, которую может найти даже в уже отмерших клетках. Все это приводит к получению ложноположительного результата. Избежать такой ситуации можно, если сдавать анализ в установленный лечащим врачом срок.
Также существует риск ложноотрицательного результата. В этом случае пациент никак не может повлиять на качество диагностики, так как ложноотрицательный анализ – просчет лаборатории. Он может возникнуть если:
- собранный материал неправильно транспортировался и хранился;
- нарушается стерильность, и в полученные пробы попадают другие микроорганизмы;
- реагенты были непригодными.
Для того чтобы исключить возможность получения ложноотрицательного результата, необходимо выбирать проверенную лабораторию с квалифицированным персоналом.
Виды методик
В рамках проведения ПЦР диагностики разработаны четыре метода тестирования. Каждый из них имеет свои особенности проведения и назначается, исходя из состояния пациента. Для выбора наилучшего способа необходимо проконсультироваться с врачом.
Качественный способ
Этот метод применяется для того, чтобы подтвердить или опровергнуть факт присутствия вируса в организме. Его основной недостаток – невозможность установить штамм ВПЧ (только 14-21 виды). Чаще всего качественный способ используется вместе с другими методами выявления папилломавируса. Результат при этом передается с помощью 2 оценок: «обнаружено» или «не обнаружено». То есть метод либо констатирует факт наличия чужой ДНК, либо показывает ее отсутствие.
Генотипирование
Методика способна определить как просто наличие вируса в организме, так и установить его вид. Этот способ применяют, когда необходимо установить, осталась ли вирусная ДНК после лечения или случился рецидив вследствие нового заражения. Генотипирование позволяет оценить эффективность проведенного лечения посредством определения вида вируса. Если этот тот же штамм, от которого лечился больной, значит, терапия прошла безуспешно. Если же исследование показывает другой вид ВПЧ, можно говорить о повторном заражении. Результат также представлен формулировками «обнаружено» или «не обнаружено».
Комбинированный метод
Узкоспециализированный способ диагностики, основанный на соединении качественного метода и определения 16 штамма посредством генотипирования. Результат представлен 3 ответами: «не обнаружено», «обнаружен 16 штамм», «обнаружен ВПЧ с 16 типом включительно». Этот метод применяется при подозрении на наличие высокоонкогенного типа папилломавируса, способного вызывать у женщин рак шейки матки.
Количественный метод
Такой способ позволяет установить концентрацию вируса в организме и отследить развитие ВПЧ. Считается наиболее информативным, так как позволяет определить тяжесть протекающего процесса, исходя из которой, подбирается лечение. Основан на определении количества вирусных клеток в рамках исследуемых 100 тысяч. Когда их совокупность превышает 5, это свидетельствует о высокой концентрации папилломавируса, что повышает возможность появления раковых клеток. Если количество клеток меньше 3, концентрация указывается как незначительная.
Как сдавать анализ
Специальной подготовки для проведения диагностики не требуется. Главное условие – не мочиться за несколько часов до процедуры. Желательно не вступать в половые контакты за 2-3 дня до обследования, а также не принимать алкоголь. При этом нельзя забывать о проведении процедур для поддержания интимной гигиены.
Как сдают анализ мужчины
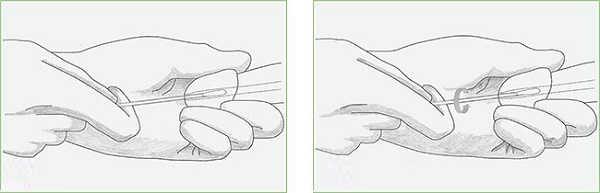 Головка полового органа вместе с мочеиспускательным каналом обрабатывается физ. раствором. Врач использует специальную щеточку, вставляемую примерно на 4 сантиметра. С помощью легкого вращения собирается материал для исследования с уретры. Полученный анализ оставляется в пробирке и отправляется на дальнейшее исследование в лабораторию. Биоматериал при этом может храниться не более 2 суток с момента получения.
Головка полового органа вместе с мочеиспускательным каналом обрабатывается физ. раствором. Врач использует специальную щеточку, вставляемую примерно на 4 сантиметра. С помощью легкого вращения собирается материал для исследования с уретры. Полученный анализ оставляется в пробирке и отправляется на дальнейшее исследование в лабораторию. Биоматериал при этом может храниться не более 2 суток с момента получения.
Как сдают анализ женщины

Перед взятием анализа на шейку матки наносят стерильный раствор. Затем с помощью щеточки берется мазок из цервикального канала. Приспособление оказывается на глубине около сантиметра, потом врач делает соскоб со стенок вращательными движениями. Биоматериал помещается в пробирку, где находится примерно 15 секунд. Там врач обтирает его об стенки, а затем вынимает. После этого содержимое пробирки отправляется на диагностику.
Забор биоматериала
Правильный забор материала – залог успешного проведения диагностики. Если при этом процессе нарушается стерильность, и в пробирку попадают чужеродные микроорганизмы, может произойти обнаружение «вируса», которого в действительности нет. Кроме того, ошибка может произойти из-за небольшого количества клеток, взятых на анализ.
Расшифровка анализа ПЦР
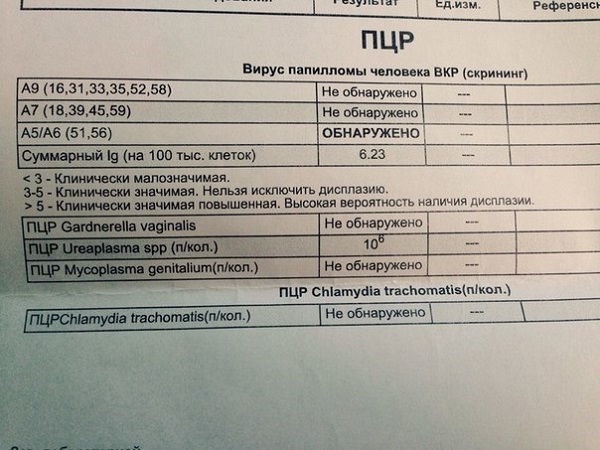
В зависимости от способа диагностики пациент увидит различные контрольные результаты. Графа «не обнаружено» свидетельствует о том, что вирус не присутствует в организме, либо его количество настолько незначительно, что не поддается обнаружению. Результат «обнаружено», соответственно, говорит о наличии патологического процесса.
Если пациент использовал количественный метод, расшифровка будет следующей:
- Lg 5 и выше – показатель большой концентрации вируса;
- Lg 3−5 – уровень вируса значительный, но не критический;
- Lg меньше 3 – малозначимое количество вирусных клеток.
В любом случае точной расшифровкой должен заниматься врач, ведь на основании этого ставится диагноз. Кроме того, через какое-то время желательно повторить процедуру, чтобы исключить ложноотрицательный или ложноположительный результат.
Источник
ВПЧ – группа распространенных и генетически разнообразных вирусов, инфицирующих и поражающих эпителий кожных покровов (кожные типы ВПЧ) и слизистых оболочек ротовой полости и аногенитальной области (генитальные типы ВПЧ). Генитальные типы ВПЧ передаются преимущественно половым путем и через родовые пути от матери ребенку. Основными клиническими формами папилломавирусной инфекции гениталий являются остроконечные кондиломы, а также злокачественные формы изменения эпителиальных клеток, приводящие к раку шейки матки.
Исход инфекции зависит от типа вируса. Типы ВПЧ низкого канцерогенного риска (НКР, низкоонкогенные) связаны с остроконечными кондиломами и дисплазиями легкой степени. Типы ВПЧ высокого канцерогенного риска (ВКР, высокоонкогенные) – 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 – наряду с остроконечными кондиломами и дисплазиями легкой степени, также индуцируют злокачественную трансформацию эпителия, приводящую к инвазивному раку.
Дифференциальная диагностика. Поражения шейки матки, влагалища, вульвы, пениса, заднего прохода непапилломавирусной этиологии; в случае остроконечных кондилом – с проявлениями, связанными с вирусом простого герпеса, а также с истинными папилломами.
Лабораторная диагностика папилломавирусной инфекции включает выявление и количественное определение ДНК ВПЧ ВКР, генотипирование ВПЧ ВКР, выявление ДНК ВПЧ НКР.
Материал для исследования
- Соскобы эпителия цервикального канала, влагалища, вульвы, заднего прохода – для выявления, количественного определения и генотипирования ВПЧ;
- мазки из ротовой полости и гортани – выявления ВПЧ НКР у детей.
Выявление и определение концентрации вируса папилломы человека высокого канцерогенного риска
Показания к обследованию
- Определение группы риска по развитию рака шейки матки и рака заднего прохода;
- скрининговые программы с цитологическим исследованием одновременно или на первом этапе скрининга (до цитологического исследования) для женщин старше 30 лет;
- разрешение неопределенных и сомнительных результатов цитологических исследований (наличие ASCUS – атипичные плоские клетки неясного значения);
- контроль эффективности терапии тяжелой дисплазии (CIN2+) через 6 месяцев после удаления пораженного эпителия;
- проведение дифференциальной диагностики с заболеваниями непапилломарусной этиологии.
Сравнительная характеристика методов лабораторной диагностики. Для выявления ДНК ВПЧ ВКР используют МАНК (ПЦР, NASBA, TMA и др.) и методы амплификации сигнала (гибридный захват). Культивировать вирус не удается.
Гибридный захват является первым и наиболее охарактеризованным методом выявления ДНК ВПЧ. Применение метода позволяет определять концентрацию вируса в условных единицах оптической плотности, линейный диапазон небольшой (3–4 порядка). Образцы, в которых присутствует вирус в концентрации ниже порога клинической значимости, учитываются как отрицательные. Граница клинической значимости определяется путем тестирования эталонного образца (концентрация ДНК ВПЧ 1 пг/мл). Все сигналы, значения которых ниже эталонного, считаются отрицательными. Более современными, быстрыми и удобными для использования являются методы на основе АНК. МАНК, работающие в неколичественном формате, выявляют либо ДНК вируса (ПЦР, HDA и др.), либо мРНК транскрипты онкогенов E6 и E7 ВПЧ (NASBA, TMA). Для выявления только клинически значимых концентраций (по разным методикам учета – более 1 пг/мл или 1000 копий ДНК вируса на 100000 клеток человека) используют методики с чувствительностью, при которой образцы с низкой концентрацией учитываются как отрицательные. Наиболее целесообразно использовать ПЦР в реальном времени, которая позволяет точно определить концентрацию ДНК вируса. На основе полученных данных проводится не только оценка концентрации вируса, но, что важно, проводится градация результата по клинической значимости полученной концентрации на:
- положительный – выше порога клинической значимости;
- положительный – малозначимый (ниже порога значимости);
- отрицательный.
Различные наборы реагентов могут отличаться спектром выявляемых генотипов. К группе ВПЧ ВКР относятся 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 генотипы. Наиболее канцерогенными считаются 16 и 18 типы, наименее – 51, 56, 68. Для РФ и стран СНГ клинический смысл исследования сохраняется только при определении как минимум 10 генотипов из перечисленных выше. Выявление в смеси генотипов низкого или неустановленного риска существенно снижает специфичность выделения группы риска онкологической патологии и не может быть оправдано.
Показания к применению различных лабораторных исследований. Для проведения скринингового обследования на наличие предрака и рака шейки матки предпочтительным является использование мазков/соскобов эпителия цервикального канала и зоны трансформации, выполненных цервикальными цитологическими щеточками. Допускается использование для этих целей мазков из влагалища. Для скрининга рака шейки матки все тесты, вне зависимости от выбранной технологии, должны иметь сбалансированные аналитические и диагностические характеристики, удовлетворяющие следующим условиям – не менее 98% чувствительность по отношению к CIN2+ и не менее 90% специфичность относительно широко валидированного в скрининге теста (например, Hybrid Capture II). Для достижения оптимума аналитической чувствительности избирают подход отсечения образцов с концентрацией ДНК ВПЧ ниже порога клинической значимости. Для этого либо проводят искусственное снижение аналитической чувствительности, либо выбирают в качестве референтного контрольный образец с требуемой пороговой концентрацией. Предпочтительным является измерение концентрации ДНК ВПЧ методом ПЦР в реальном времени.
Особенности интерпретации результатов лабораторных исследований. Обнаружение ДНК ВПЧ в любой концентрации свидетельствует о наличии возбудителя, однако при интерпретации результатов тестирования следует учитывать, что более 80% инфицированных спонтанно излечиваются в течение 12–24 мес. Опасность представляет персистентная форма инфекции (сохраняющаяся более 12–24 мес.). Однократный положительный результат надежно указывает на принадлежность к группе риска развития рака шейки матки в случае, если исследование проводится в группе женщин старше 30 лет или вступивших в половую жизнь более 6–7 лет назад. Особая настороженность должна быть проявлена в отношении пациенток, у которых подтверждается персистенция вируса при повторном тестировании через 1 год. При скрининге с использованием количественных тестов принимают во внимание только клинически значимый результат. Для дифференциальной диагностики и наблюдения пациентов после проведения лечения дополнительная ценность одиночного количественного определения не показана. Перспективным в прогнозе риска рецидива CIN2+ является оценка динамики вирусной нагрузки после лечения (снижение или увеличение концентрации вируса).
Генотипирование вирусов папилломы человека. Цель генотипирования ВПЧ – отличие персистирующей инфекции от случая повторного инфицирования (сохранение генотипа в повторных тестах); уточнение тактики ведения больных в зависимости от онкогенности выявленных типов вируса.
Показания к обследованию. Пациенты с выявленной папилломавирусной инфекцией ВКР
Сравнительная характеристика методов лабораторной диагностики. Для генотипирования ВПЧ используют МАНК. Распространение получили методики с детекцией продуктов амплификации методом электрофореза (генотипирование по величине амплифицируемого фрагмента), гибридизации на плашках и стрип-полосках, ПЦР в реальном времени.
Классические методики, использующие принцип гибридизации со специфическими зондами позволяют определять наиболее широкий спектр генотипов (20–40). Однако использование для амплификации универсальных праймеров приводит к существенным различиям в аналитической чувствительности выявления различных генотипов ВПЧ, приводя к заметным искажениям результатов. Кроме того, широкий спектр определяемых генотипов необходим только для научных исследований. В клинической практике достаточным может считаться генотипирование ВПЧ ВКР (10–13 типов). Методики, основанные на применении типоспецифических олигонуклеотидов, позволяют проводить типирование спектра клинически значимых генотипов и в заметной степени лишены проблемы различий аналитической чувствительности по отношению к разным генотипам ВПЧ. Предпочтение должно отдаваться мультиплекс-методикам с использованием ПЦР в реальном времени как наиболее быстрым, контаминационно безопасным, предполагающим возможность автоматизации. Может проводиться сокращенное генотипирование с выявлением только наиболее онкогенных типов ВПЧ 16 и 18.
Особенности интерпретации результатов лабораторных исследований. Для установления персистенции вируса применяют подход повторного генотипирования через 12 месяцев. Персистенция подтверждается при сохранении генотипа/ генотипов при повторном исследовании, полная смена спектра генотипов указывает на излечение и повторное инфицирование альтернативными ВПЧ. Выявление наиболее онкогенных типов ВПЧ (16 и 18) может указывать на потребность в более агрессивной тактике ведения больных (более частые повторные визиты, более тщательное обследование для выявления предраковых изменений и др.).
Выявление вирусов папилломы человека низкого канцерогенного риска
Показания к обследованию
- Определение группы риска развития папилломатоза гортани у ребенка (беременные и новорожденные);
- дифференциальная диагностика с заболеваниями непапилломавирусной этиологии.
Сравнительная характеристика методов лабораторной диагностики. Для выявления ДНК ВПЧ НКР используют МАНК (ПЦР, NASBA, TMA и др.) и методы амплификации сигнала (гибридный захват). Предпочтение должно отдаваться быстрым и контаминационно-безопасным методикам, таким как ПЦР в реальном времени.
Клинически оправданным является определение двух генотипов 6 и 11 (более 90% случаев папилломатоза гортани у детей). Некоторую дополнительную ценность имеет выявление 42, 43 и 44 генотипов. Количественное определение не оправдано.
Особенности интерпретации результатов лабораторных исследований. Выявление 6 и/или 11 генотипов указывает на возможный риск развития папилломатоза гортани у ребенка (риск повышается, если вирус обнаружен в гортани). При планировании беременности может быть рекомендована выжидательная тактика. При сопутствующем наличии остроконечных кондилом – их лечение методом химической и/или физической деструкции. При наличии беременности ее прерывание или родоразрешение методом кесарева сечения не оправданы, так как риск развития папилломатоза гортани ниже риска возможных осложнений указанных операций.
Источник


