Квадривалентная вакцина от впч

Вакцины, сыворотки, фаги и анатоксины
Входит в состав препаратов
Входит в перечень (Распоряжение Правительства РФ № 2782-р от 30.12.2014):
ЖНВЛП
АТХ:
J.07.B Вакцины для профилактики вирусных инфекций
J.07 Вакцины
Фармакодинамика:
Квадривалентная рекомбинантная вакцина против вируса папилломы человека.
Эффективность вакцины опосредована формированием защитного иммунитета с развитием гуморального и клеточного иммунного ответа против вируса папилломы человека. Риск инфицирования вирусом папилломы человека в течение жизни, без вакцинации, у сексуально активных людей более 50%, и он постоянно растет. Проведение курса вакцинации препаратом приводит к профилактике заболеваний, вызываемых вирусом папилломы человека.
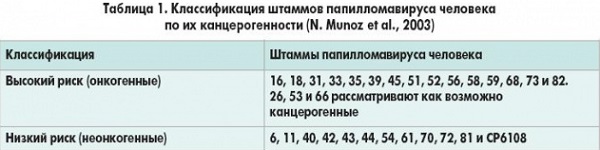
Инфицирование онкогенными типами вирусов папилломы человека – это обязательное условие развития рака шейки матки (плоскоклеточного и аденокарциномы) и предраковых диспластических состояний. Кроме того, у мужчин и женщин вирус папилломы человека является причиной рака наружных половых органов и анального канала, значительно повышает риск развития рака органов головы и шеи, особенно рака ротоглотки, приводит к развитию аногенитальных кондилом и вызывает рецидивирующий респираторный папилломатоз детей и взрослых.
Клиническая эффективность. На основании проведенных исследований у 24358 женщин и девочек от 9 до 45 лет и у 4055 мужчин и мальчиков от 9 до 26 лет был подтвержден высокий профиль эффективности и безопасности вакцины.
У женщин от 16 до 26 лет вакцина эффективно предотвращала рак и предраковые диспластические состояния шейки матки, вульвы, влагалища, а также аногенитальные кондиломы в 98-100% случаев. Анализ перекрестной защитной эффективности показывает, что введение вакцины способствует снижению риска развития дисплазии шейки матки (CIN 1/2/3) и аденокарциномы in situ (AIS), вызываемых наиболее распространенными онкогенными типами вируса папилломы человека, не входящими в состав вакцины.
У женщин от 24 до 45 лет вакцина была эффективна для профилактики персистирующей инфекции CIN (любой степени) или аногенитальных поражений, вызванных вирусами папилломы человека 6-го, 11-го, 16-го и 18-го типов, в 88,7% случаев.
У юношей и мужчин вакцина предотвращала наружные генитальные поражения (аногенитальные кондиломы и перинеальную, перианальную внутриэпителиальную неоплазию, внутриэпителиальную неоплазию пениса 1-й/2-й/3-й степени), вызванные вирусом папилломы человека 6-го, 11-го, 16-го, 18-го типов, в 90,6% случаев, а также анальную внутриэпителиальную неоплазию (AIN) 1-й/2-й/3-й степени в 77,5% случаев.
Иммуногенность
Проведение полного курса вакцинации приводит к образованию специфических антител к четырем типам вируса папилломы человека – 6-му, 11-му, 16-му и 18-му – более чем у 98% вакцинируемых. Было показано наличие иммунологической памяти при вакцинации серопозитивных (на момент вакцинации) женщин. Кроме того, у женщин, которые получили дополнительную дозу вакцины через пять лет после завершенного курса вакцинации, наблюдался быстрый и выраженный анамнестический иммунный ответ, при котором средние геометрические титры антител превышали титры, полученные через месяц после первичной вакцинации.
Фармакокинетика:
Данные по фармакокинетике вакцины отсутствуют.
Показания:
Профилактика следующих заболеваний у девочек и женщин в возрасте от 9 до 45 лет:
рак шейки матки, вульвы, влагалища и анального канала, вызванный вирусом папилломы человека 16-го и 18-го типов;
аногенитальные кондиломы (condiloma acuminata), вызванные вирусом папилломы человека 6-го и 11-го типов;
цервикальная внутриэпителиальная неоплазия 1-й/2-й/3-й степени (СIN), аденокарцинома шейки матки in situ (AIS), вызванные вирусом папилломы человека 6-го, 11-го, 16-го и 18-го типов;
внутриэпителиальная неоплазия вульвы (VIN) и влагалища (VaIN) 1-й/2-й/3-й степени, вызванные вирусом папилломы человека 6-го, 11-го, 16-го и 18-го типов;
внутриэпителиальная неоплазия анального канала 1-й/2-й/3-й степени, вызванная ВПЧ 6-го, 11-го, 16-го и 18-го типов.
Вакцина может обеспечивать защиту у девочек и женщин в возрасте от 9 до 26 лет от заболеваний, вызываемых вирусами папилломы человека типов, не входящих в состав вакцины.
Вакцина показана к применению у мальчиков и мужчин в возрасте от 9 до 26 лет для профилактики следующих заболеваний:
рака анального канала, вызванного вирусами папилломы человека 16-го и 18-го типов;
аногенитальных кондилом (condiloma acuminate), вызванных вирусами папилломы человека 6-го и 11-го типов;
предраковых, диспластических состояний и внутриэпителиальной неоплазии анального канала 1-й/2-й/3-й степени, вызванных вирусом папилломы человека 6-го, 11-го, 16-го, 18-го типов.
I.A50-A64.A63.0 Аногенитальные (венерические) бородавки
I.B95-B97.B97.7 Папилломавирусы как причина болезней, классифицированных в других рубриках
II.C15-C26.C21 Злокачественное новообразование заднего прохода [ануса] и анального канала
II.C51-C58.C51 Злокачественное новообразование вульвы
II.C51-C58.C53 Злокачественное новообразование шейки матки
XXI.Z20-Z29.Z25 Необходимость иммунизации против одной из других вирусных болезней
Противопоказания:
Повышенная чувствительность к активным компонентам и наполнителям вакцины; при возникновении симптомов повышенной чувствительности к препарату введение последующей дозы вакцины противопоказано.
С осторожностью:
У детей в возрасте до 9 лет безопасность и эффективность вакцины не оценивалась.
Нет данных по оценке безопасности и эффективности вакцины у взрослых старше 45 лет.
Относительные противопоказания: нарушения свертываемости крови вследствие гемофилии, тромбоцитопении или на фоне приема антикоагулянтов. При необходимости применения вакцины у данной категории пациентов следует оценить потенциальные преимущества вакцинации и сопряженный с ней риск. При вакцинации в таких случаях необходимо принять меры для снижения риска образования постинъекционной гематомы.
Беременность и лактация:
Адекватных и строго контролируемых исследований безопасности применения препарата при беременности не проводилось.
Данных, свидетельствующих о том, что введение вакцины оказывает нежелательное воздействие на фертильность, беременность или на плод не имеется.
Данных о применении вакцины при беременности и о потенциальном воздействии вакцины на репродуктивную функцию женщины и на плод у беременных недостаточно, чтобы рекомендовать использование вакцины при беременности.
Вакцинируемых женщин следует предупредить о необходимости предохранения от беременности в течение курса вакцинации, а при наступлении беременности вакцинацию следует отложить до ее завершения.
Клинические исследования, в ходе которых была изучена эффективность, иммуногенность и безопасность вакцины у кормящих матерей и младенцев, показали, что вакцину можно вводить женщинам в период лактации (грудного вскармливания).
Способ применения и дозы:
Вакцину вводят внутримышечно в дельтовидную мышцу или верхненаружную поверхность средней трети бедра.
Вакцина не предназначена для внутривенного введения.
Для всех возрастных групп разовая доза вакцины составляет 0,5 мл.
Рекомендуемый курс вакцинации состоит из 3 доз и проводится по схеме (0-2-6 месяцев): первая доза – в назначенный день; вторая доза – через 2 месяца после первой; третья доза – через 6 месяцев после первой.
Допускается ускоренная схема вакцинации, при которой вторая доза вводится через 1 месяц после первой прививки, а третья – через 3 месяца после второй прививки.
При нарушении интервала между прививками курс вакцинации считается завершенным, если 3 вакцинации проведены в течение 1 года.
Необходимость проведения ревакцинации не установлена.
Перед употреблением флакон/шприц с вакциной встряхивают до получения однородной мутной взвеси. Утрата гомогенности, появление включенных частиц и изменение цвета суспензии свидетельствуют о непригодности вакцины.
Наполненный вакциной шприц предназначен только для однократного использования и только у одного человека.
Вскрытие флаконов и процедуру вакцинации проводят при строгом соблюдении правил асептики и антисептики. Место введения до и после инъекции обрабатывают 70% спиртом.
Следует вводить всю рекомендуемую дозу – 0.5 мл.
Побочные эффекты:
Побочные реакции, которые наблюдались в связи с введением вакцины в 1% случаев и чаще, чем у лиц, которым вводили плацебо.
Определение частоты побочных реакций: очень часто (≥ 1/10); часто (≥ 1/100, < 1/10); нечасто (≥ 1/1000, < 1/100); редко (≥ 1/10 000, < 1/1 000); очень редко (< 1/10 000).
Со стороны костно-мышечной системы: часто – боль в конечностях.
Со стороны дыхательной системы: очень редко – бронхоспазм.
Общие расстройства: часто – пирексия.
Местные реакции (чаще в группе, которой вводили вакцину по сравнению с любыми препаратами, содержащими адъювант алюминия гидроксифосфата сульфат аморфный, или по сравнению с группой, которой вводили раствор плацебо) очень часто – покраснение, боль и припухлость; часто – зуд, гематома. Большинство местных реакций были легкой степени тяжести.
Передозировка:
Имеются сообщения о случаях введения вакцины в дозах, превышающих рекомендованные. В целом характер и выраженность нежелательных явлений при передозировке были сопоставимы с таковыми при введении рекомендованных разовых доз данной вакцины.
Взаимодействие:
Результаты клинических исследований показывают, что вакцину можно вводить одновременно (в другой участок) с рекомбинантной вакциной против гепатита В, вакциной менингококковой, конъюгированной с дифтерийным анатоксином и с инактивированной вакциной против дифтерии, столбняка, коклюша (бесклеточный компонент), полиомиелита.
Применение анальгетиков, противовоспалительных препаратов, антибиотиков и витаминных препаратов не влияло на эффективность, иммуногенность и безопасность вакцины.
Гормональные контрацептивы, кортикостероиды для ингаляционного местного и парентерального применения не влияли на иммуногенность, эффективность и безопасность вакцины.
Данные об одновременном применении системных иммунодепрессантов и вакцины отсутствуют.
Особые указания:
При решении вопроса о вакцинации необходимо сопоставить возможный риск от предшествующего заражения вирусом папилломы человека и потенциальную пользу от вакцинации.
Не предназначен для лечения рака шейки матки, вульвы или влагалища, CIN, VIN или VaIN или активного кондиломатоза и применяется исключительно с профилактической целью. Вакцина предназначена для предотвращения инфицирования теми типами вируса папилломы человека, которых нет у пациента. Вакцина не оказывает влияния на течение активных инфекций, вызванных вирусами папилломы человека. Как и при введении любой другой вакцины, при применении вакцины не у всех вакцинируемых удается получить защитный иммунный ответ. Препарат не защищает от заболеваний, передающихся половым путем, другой этиологии. В связи с этим вакцинированным пациентам следует рекомендовать продолжать использование других профилактических средств защиты.
Эффективность и безопасность при подкожном и внутрикожном введении не изучались, поэтому эти способы введения не рекомендуются.
Как и при введении любой вакцины, в лечебно-профилактическом кабинете всегда требуется иметь соответствующие лекарственные средства для немедленного купирования анафилактической реакции и средства неотложной и противошоковой терапии.
Непосредственно после введения вакцины следует наблюдать за состоянием пациента в течение 30 минут с целью своевременного выявления поствакцинальных реакций и осложнений и оказания экстренной медицинской помощи. При проведении любой вакцинации может наблюдаться обморок, особенно у подростков и молодых женщин.
Решение о введении препарата или об отсрочке вакцинации в связи с текущей или недавней болезнью, сопровождающейся повышенной температурой, в большой степени зависит от этиологии заболевания и степени тяжести.
У лиц с нарушенной реактивностью иммунной системы вследствие применения иммунодепрессантов (системные кортикостероиды, антиметаболиты, алкилирующие препараты, цитотоксичные препараты), генетического дефекта, инфекции вируса иммунодефицита человека и других причин защитный эффект может быть снижен.
Вакцину следует вводить с осторожностью пациентам с тромбоцитопенией и любыми нарушениями свертывания крови, поскольку после внутримышечной инъекции у таких лиц может развиться кровотечение.
Медицинский персонал обязан предоставить всю необходимую информацию по вакцинации и вакцине пациентам, родителям и опекунам, включая информацию о преимуществах и сопряженном риске.
Вакцинируемых следует предупредить о необходимости сообщать врачу или медсестре о любых нежелательных реакциях, а также о том, что вакцинация не заменяет и не отменяет рутинных скрининговых осмотров. Для достижения эффективных результатов курс вакцинации должен быть завершен полностью, если для этого не имеется противопоказаний.
Нет данных по оценке безопасности и эффективности вакцины у взрослых старше 45 лет.
Использование в педиатрии
У детей в возрасте до 9 лет безопасность и эффективность вакцины не оценивалась.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований влияния вакцины на способность к управлению автотранспортом и работе с механизмами не проводилось.
Инструкции
Источник
 ИНСТРУКЦИЯ по применению вакцины Гардасил
ИНСТРУКЦИЯ по применению вакцины Гардасил
ГАРДАСИЛ® – зарегистрированная торговая марка компании Merck & Co., Inc., Whitehouse Station, NJ, USA
ГАРДАСИЛ® – зарегистрированная торговая марка компании Merck & Co., Inc., Whitehouse Station, NJ, USA
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
ГАРДАСИЛ®
Вакцина против вируса папилломы человека квадривалентная
рекомбинантная (типов 6, 11, 16, 18)
Регистрационный номер: ЛС -002293 от 24 ноября 2006 года
Лекарственная форма: Суспензия для внутримышечного введения
Квадривалентная вакцина против вируса папилломы человека (ВПЧ) представляет
собой стерильную суспензию для внутримышечного введения, приготовленную из
смеси высокоочищенных вирусоподобных частиц (ВВЧ) рекомбинантного основ-
ного капсидного белка (L1) ВПЧ типов 6, 11, 16 и 18. Белки L1 продуцируются путем
раздельной
ферментации в рекомбинантных Saccharomyces cerevisiae CANADE 3C-5
(штамм 1895) и образуют ВВЧ путем самосборки. ВВЧ для каждого типа очищаются
и адсорбируются на алюминий-содержащем адъюванте (аморфный гидроксифосфат-
сульфат алюминия).
СОСТАВ
Одна доза (0,5 мл) содержит:
Активные вещества – иммуногены: Рекомбинантные антигены: L1-белок виру-
са папилломы человека в следующих соотношениях: тип 6 (20 мкг), тип 11 (40 мкг),
тип 16 (40 мкг), тип 18 (20 мкг).
Вспомогательные вещества: Алюминий в виде адъюванта – алюминия гидрокси-
фосфат-сульфата аморфного – 225 мкг, натрия хлорид – 9,56 мг, L-гистидин – 0,78 мг,
полисорбат – 80 – 50 мкг, натрия борат – 35 мкг, вода для инъекций.
Утверждаю:
Главный государственный
санитарный врач Российской Федерации
_________________________ Г. Г. Онищенко
08 ноября 2006 года
№ 01-11/187-06
ОПИСАНИЕ
Непрозрачная суспензия белого цвета.
ИММУНОБИОЛОГИЧЕСКИЕ СВОЙСТВА
Проведение полного курса вакцинации приводит к образованию специфических ан-
тител к четырем типам ВПЧ – 6, 11, 16 и 18 – в защитном титре более чем у 99% вакци-
нированных на период не менее 36 месяцев во всех возрастных группах.
Вакцина ГАРДАСИЛ® обладает практически 100%-ной эффективностью в предотвращении
индуцированных 6, 11, 16 и 18 типами ВПЧ раковых заболеваний
половых органов, предраковых эпителиальных дисплазий и генитальных кон-
дилом.
НАЗНАЧЕНИЕ
Вакцина ГАРДАСИЛ® показана к применению детям и подросткам в возрасте от 9 до 17
лет и молодым женщинам в возрасте от 18 до 26 лет для предупреждения перечисляе-
мых далее заболеваний, вызываемых вирусом папилломы человекатипов 6, 11, 16 и 18:
• рака шейки матки, вульвы и влагалища
• генитальных кондилом (condiloma acuminata)
Предраковых диспластических состояний:
• аденокарциномы шейки матки in situ (AIS)
• цервикальной внутриэпителиальной неоплазии II и III степени (СIN 2/3)
• внутриэпителиальной неоплазии вульвы II и III степени (VIN 2/3)
• внутриэпителиальной неоплазии влагалища II и III степени (VaIN 2/3)
• цервикальной внутриэпителиальной неоплазии I степени (CIN 1)
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Вакцину ГАРДАСИЛ® вводят внутримышечно в дельтовидную мышцу или переднела-
теральную область бедра. Не вводить внутривенно.
Разовая доза вакцины для всех возрастных групп составляет 0,5 мл.
Рекомендуемый курс вакцинации состоит из 3-х доз и проводится по схеме
(0 – 2 – 6 мес):
Первая доза – в назначенный день
Вторая доза – через 2 мес после первой
Третья доза – через 6 мес после первой.
Допускается ускоренная схема вакцинации, при которой вторая доза вводится через
1 мес после первой прививки, а третья – через 3 мес после второй прививки.
При нарушении интервала между прививками курс вакцинации считается завершен-
ным, если три вакцинации проведены в течение 1 года.
Вакцина готова к применению, дополнительного разведения или ресуспендирова-
ния не требуется. Перед употреблением флакон/шприц с вакциной встряхивают до
получения однородной мутной взвеси. Утрата гомогенности, появление включенных
частиц и изменение цвета суспензии свидетельствуют о непригодности вакцины.
Наполненный вакциной шприц предназначен только для однократного использова-
ния и только у одного человека.
Вскрытие флаконов и процедуру вакцинации проводят при строгом соблюдении пра-
вил асептики и антисептики. Место введения до и после инъекции обрабатывают 70%
спиртом.
Следует вводить всю рекомендуемую дозу.
Использование флаконов с разовой дозой вакцины
Наберите 0,5 мл взвеси из флакона с разовой дозой вакцины стерильной иглой в од-
норазовый шприц, не содержащий консервантов, антисептиков и детергентов. Вве-
дите всю дозу. Флакон с остатками вакцины выбросите.
Использование шприцев с разовой дозой вакцины
Введите все содержимое шприца полностью.
Инструкция по применению одноразовых, стерильных, предварительно запол-
ненных шприцев с одной дозой в комплекте с защитным устройством.
Используйте для введения вакцины вложенную иглу. Если вы хотите использовать
другую, убедитесь, что игла надежно присоединяется к шприцу и ее длина не превы-
шает 2,5 см, что является необходимым условием для правильной работы защитного
устройства.
Снимите колпачок с конца шприца. Нажав оба препятствующих вращению выступа,
закрепите шприц и присоедините иглу Люэра поворотом по часовой стрелке.
Удалите защитный колпачок с иглы.
При проведении инъекции, как указано выше, нажимайте на поршень, крепко удер-
живая шприц под пальцевыми выступами, и вводите всю дозу. Защитное устройс-
тво иглы НЕ сработает, если не будет введена ВСЯ доза. Извлеките иглу. Отпустите
поршень и дайте шприцу переместиться вверх до полного закрытия всей иглы. Для
документирования вакцинации отделите съемные этикетки, медленно потянув их.
Выбросите шприц в контейнер для острых предметов.
ПОБОЧНЫЕ ДЕЙСТВИЯ
После введения вакцины в отдельных случаях могут развиваться местные и общие
реакции: по данным проведенных клинических исследований следующие нежелатель-
ные явления встречались с частотой не менее 1,0% и чаще, чем в группе плацебо.
Местные реакции выражаются в покраснении, припухлости, болезненности и зуде в
месте введения. Продолжительность реакций не превышает 5 суток и не требует на-
значения медикаментозной терапии.
Наиболее характерными общими реакциями являются головная боль, кратковре-
менное повышение температуры тела. Отмечены отдельные случаи гастроэнтерита
и воспаления органов малого таза.
Учитывая теоретическую возможность развития аллергических реакций немедлен-
ного типа у особо чувствительных лиц, необходимо обеспечить медицинское наблю-
дение за привитыми в течение 30 мин.
Места проведения вакцинации должны быть обеспечены средствами противошоко-
вой терапии.
ПРОТИВОПОКАЗАНИЯ
Гиперчувствительность к активным компонентам и наполнителям вакцины.
При возникновении симптомов гиперчувствительности после введения вакцины
ГАРДАСИЛ® введение последующей дозы вакцины противопоказано.
Нарушения свертываемости крови вследствиегемофилии, тромбоцитопении или на
фоне приема антикоагулянтов являются относительным противопоказанием к внут-
римышечному введению вакцины ГАРДАСИЛ®, если только потенциальные преиму-
щества вакцинации не превышают в значительной мере сопряженные с ней риски.
Если выбор сделан в пользу вакцинации, необходимо принять меры по снижению
риска образования постинъекционной гематомы.
ПРИМЕНЕНИЕ В ПЕДИАТРИИ
У детей в возрасте до 9 лет безопасность и эффективность вакцины ГАРДАСИЛ®
не оценивалась.
БЕРЕМЕННОСТЬ И ЛАКТАЦИЯ
Вакцина ГАРДАСИЛ® отнесена к категории «В».
Специально спланированных и хорошо контролируемых исследований у беремен-
ных женщин не проводилось. Потенциальное воздействие вакцины на репродуктив-
ную функцию женщины и на плод у беременных не изучалось.
Данных, свидетельствующих о том, что введение вакцины ГАРДАСИЛ® оказывает не-
желательное воздействие на фертильность, беременность или на плод, не имеется.
Вакцину ГАРДАСИЛ® можно вводить кормящим женщинам.
Взаимодействие с другими лекарственными средствами
Применение с другими вакцинами
Результаты клинических исследований показывают, что вакцину ГАРДАСИЛ® можно вво-
дить одновременно (в другой участок) с рекомбинантной вакциной против гепатита В.
Применение с распространенными лекарствами
Применение анальгетиков, противовоспалительных препаратов, антибиотиков и ви-
таминных препаратов не влияло на эффективность, иммуногенность и безопасность
вакцины.
Применение с гормональными контрацептивами
Применение гормональных контрацептивов не влияло на иммунный ответ на
вакцину ГАРДАСИЛ®.
Применение со стероидами
Ингаляционные, местные и парентеральные стероиды не влияли на
иммунный ответ вакцины ГАРДАСИЛ®.
Применение с системными иммунодепрессантами
Данные об одновременном применении сильных иммунодепрессантов и вакцины
ГАРДАСИЛ® отсутствуют.
ПРЕДУПРЕЖДЕНИЯ
Общие
Подкожное и внутрикожное введение вакцины не изучалось и поэтому не рекомен-
дуется.
Вакцина ГАРДАСИЛ® не предназначена для лечения: рака шейки матки, вульвы или
влагалища, CIN, VIN или VaIN или активного кондиломатоза.Препарат не защищает
от заболеваний, вызванных ВПЧ иных типов и другой этиологии.
Как и при введении любой инъецируемой вакцины, всегда нужно иметь наготове со-
ответствующие лекарственные средства на случай развития редкой анафилактичес-
кой реакции на введение вакцины.
Решение о введении препарата или отсрочке вакцинации в связи с текущей или не-
давней болезнью, сопровождающейся повышенной температурой, в большой степе-
ни зависит от этиологии заболевания и степени его тяжести. Небольшое повышение
температуры и легкая инфекция верхних дыхательных путей обычно не являются
противопоказаниями для вакцинации.
У лиц с нарушенной реактивностью иммунной системы вследствие применения имму-
нопрессантной терапии (системные кортикостероиды, антиметаболиты, алкилирующие
препараты, цитотоксичные препараты), генетического дефекта, инфекции вирусом имму-
нодефицита человека (ВИЧ) и других причин защитный эффект может быть снижен.
Вакцину ГАРДАСИЛ® следует вводить с осторожностью лицам с тромбоцитопенией и
любыми нарушениями свертывания крови, поскольку после внутримышечной инъ-
екции у таких лиц может развиться кровотечение.
Медицинский персонал обязан предоставить всю необходимую информацию по вак-
цинации и вакцине пациентам, родителям и опекунам, включая информацию о пре-
имуществах и сопряженных с ними рисках.
Вакцинируемых следует предупредить о необходимости предохранения от беременнос-
ти в течение курса вакцинации, о необходимости сообщать врачу или медсестре о любых
нежелательных реакциях, а также о том, что вакцинация не заменяет и не отменяет ру-
тинных скрининговых осмотров. Для достижения эффективных результатов курс вакци-
нации должен быть завершен полностью, если для этого не имеется противопоказаний.
ПРИМЕНЕНИЕ В ГЕРИАТРИИ
Нет данных по оценке безопасности и эффективности вакцины ГАРДАСИЛ® у взрос-
лых лиц старше 26 лет.
ПЕРЕДОЗИРОВКА
Имелись сообщения о случаях введения вакцины ГАРДАСИЛ® в дозах, превышающих
рекомендованные. В целом характер и выраженность нежелательных явлений при
передозировке были сопоставимы с таковыми при введении рекомендованныхра-
зовых доз вакцины ГАРДАСИЛ®.
ФОРМА ВЫПУСКА
Флакон
Первичная упаковка: 1 доза (0,5 мл) помещена во флакон (объем – 3 мл) из трубчатого
боросиликатного стекла. Флакон укупорен хлорбутиловой пробкой с тефлоновым
покрытием под алюминиевой обкаткой и закрыт зеленой защелкивающейся пласти-
ковой крышкой.
Вторичная упаковка: 1 или 10 флаконов помещены в картонную пачку вместе с инс-
трукцией по применению.
Одноразовый шприц
Первичная упаковка: 1 доза (0,5 мл) в одноразовом стерильном шприце (объем – 1,5 мл)
из боросиликатного стекла. Шприц с устройством для безопасного введения (или без
него), оснащен поликарбонатным адаптером, защитным бромбутиловым колпачком и
поршнем, закрытым пробкой из бутилкаучука, покрыт силиконом.
1 одноразовый, стерильный, предварительно заполненный шприц в комплекте с 1
или 2 стерильными иглами (или без игл) помещен в контурную ячейковую упаковку
с крышкой.
6 одноразовых, стерильных, предварительно заполненных шприцев в комплекте с 1
или 2 стерильными иглами (или без игл) в каждую ячейку, помещены в контурную
ячейковую упаковку с крышкой.
Вторичная упаковка: 1 или 6 одноразовых стерильных шприцев, запечатанных в кон-
турную ячейковую упаковку с крышкой, помещены в картонную пачку вместе с инс-
трукцией по применению.
УСЛОВИЯ ХРАНЕНИЯ
При температуре от +2 до +8 °С, в защищенном от света месте.
Не замораживать.
Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ:
3 года. Не использовать по истечении срока годности, указанного на упаковке, и при
визуальном изменении физических свойств суспензии.
УСЛОВИЯ ОТПУСКА ИЗ АПТЕК
По рецепту.
Комплект из 6 одноразовых стерильных шприцев или 10 флаконов предназначен для
санитарно-профилактических и лечебно-профилактических учреждений.
НАЗВАНИЕ И АДРЕС ИЗГОТОВИТЕЛЯ
«Мерк Шарп и Доум Б.В.», Нидерланды
Ваардервег 39, 2031 БН Хаарлем, Нидерланды / Waarderweg 39, 2031 BN Haarlem,
The Netherlands.
Рекламации по поводу специфических и физических свойств вакцины и всех случаев по-
вышенной реактогенности или развития поствакцинальных осложнений направляют:
10
· в ФГУН «Государственный НИИ стандартизации и контроля медицинских биологи-
ческих препаратов им. Л.А. Тарасевича»
119002, Москва, пер. СивцевВражек, 41; тел./факс: (495) 241-39-22
· в Представительство компании-производителя на территории России и стран
СНГ: «Мерк Шарп и Доум ИДЕА, Инк.», Швейцария
121059, Россия, Москва, площадь Европы, 2, Гостиница «Радиссон-Славянская»,
Южное крыло, тел.: (495) 941-82-75, факс: (495) 941-82-76.
Представительство компании: «Meрк Шарп и Доум ИДЕА, Инк.»
121059, Москва, Россия, площадь Европы, 2,
гостиница «Радиссон-Славянская», Южное крыло.
Тел.: (495) 941-82-75, факс: (495) 941-82-76.
Перед назначением вакцины ГАРДАСИЛ, пожалуйста, ознакомьтесь с Инструкцией по применению
121059, Москва, пл. Европы, 2, гостиница
«Радиссон-Славянская», Южное крыло
Тел.: (495) 941-8275, факс: (495) 941-8276
12-2009-GRD-2006-RUCB-11-PC
Источник