Ki 67 при меланоме

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Новикова И.А.
1
Максимова Н.А.
1
Позднякова В.В.
1
Максимова М.И.
1
Ильченко М.Г.
1
Ульянова Е.П.
1
Гранкина А.О.
1
1 Ростовский научно-исследовательский онкологический институт
В последние годы в разных странах мира отмечается значительный рост заболеваемости меланомой кожи (МК). Она варьирует от 5 до 30 случаев и более на 100 000 населения в год, а частота ее составляет 1-4% всех злокачественных опухолей. Изучение белков, определяющих инвазивный потенциал клеток, может способствовать разработке новых стратегий диагностики, прогнозирования и лечения меланоцитарных образований кожи (МОК). Мы изучили экспрессию некоторых молекулярно-биологических маркеров, контролирующих апоптоз (р53), пролиферацию (ki-67), ангиогенез (CD31, VEGF) в ткани МОК у 15 больных с пигментными доброкачественными образованиями (из них 5 больных с диспластическими невусами) и у 11 больных с МК. При оценке пролиферативного потенциала МОК выявлено наличие умеренной пролиферативной активности ki-67 у 11 больных (100%) МК и у 5 (33,3%) с невусами, которые были определены как диспластические. Положительная экспрессия р53 (˃25%) наблюдалась у 54,5% (6) пациентов с МК, тогда как в группе с невусами данная экспрессия не была отмечена. Нами выявлены достоверно значимые различия в экспрессии VEGF среди исследуемых групп, где среднее содержание клеток VEGF+ составило 32,5 ± 2,9%, тогда как в невусах 23,8 ± 2,1% (р˂0,05). При количественной оценке внутриопухолевой микрососудистой плотности выявлено, что среднее количество сосудов микроциркуляторного русла в поле зрения при меланоме и невусах составило 10,0±0,9 и 4,1±0,4 соответственно, результаты экспрессии CD31 статистически достоверны (р˂0,05). Хотя и прослеживается достоверная разница в экспрессии ki-67, р53, VEGF и CD31 между меланомами и невусами, но достаточно высокая чувствительность данных иммуногистохимических маркеров не всегда сопровождается необходимой специфичностью, что не позволяет, в частности, дифференцировать различные виды невусов.
молекулярно-биологических маркеры
невус
меланома кожи
меланоцитарные образования кожи
1. Архипова О.Е., Черногубова Е.А., Лихтанская Н.В., Тарасов В.А., Кит О.И., Матишов Д.Г. Анализ встречаемости онкологических заболеваний в Ростовской области. Пространственная статистика // Фундаментальные исследования. – 2013. – № 7-3. – С. 504-510.
2. Константинова М.М. Ингибиторы внутриклеточной передачи сигнала при меланоме: перспективы и разочарования таргетной терапии // Современная онкология. – 2007. – Т. 9, № 3. – С. 46.
3. Мазуренко Н.Н. Генетические особенности и маркеры меланомы кожи // Успехи молекулярной онкологии. – 2014. – № 2. – С. 26-35.
4. Петров С.В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей человека. – Казань, 2012. – С. 84, 409.
5. Саламова И.В. и др. Роль иммуногистохимии в дифференциальной диагностике новообразований кожи меланоцитарного генеза // Иммунопатология, Аллергология, Инфектология. – 2015. – №. 1. – С. 77.
6. Франциянц Е.М., Позднякова В.В., Максимова Н.А., Курышова М.И., Ильченко М.Г. Некоторые молекулярно-биологические аспекты патогенеза меланомы кожи // Современные проблемы науки и образования. – 2015. – № 1-2. – URL: https://science-education.ru/ru/article/view?id=20062 (дата обращения: 05.08.2016).
7. Bandovkina V., Kit O., Frantsiyants E. et al. Activity of components of plasminogen activation system in dynamics of transplantable B16/F10 melanoma development // J. Clin. Oncol. – 2016. – 34 (suppl; abstr e21062).
8. Curtin J.A., Fridlyand J., Kageshita T. et al. Distinct sets of genetic alterations in melanoma // N. Engl. J. Med. – 2005. – 353 (20):2135–47.
9. Li L.X. [et al.] A zonal comparison of MIB1-Ki67 immunoreactivity in benign and malignant melanocytic lesions // Am. J. Dermatopathol. – 2000. – Vol. 22 (6). – P. 489-95.
10. Vredeveld L.C., Possik P.A., Smit M.A. et al. Abrogation of BRAFV600E-induced senescence by PI3K pathway activation contributes to melanomagenesis. Genes Dev. – 2012. – 26 (10):1055–69.
Меланома кожи (МК) – злокачественная опухоль из клеток меланоцитарной системы и одно из наиболее агрессивно протекающих злокачественных новообразований человека, обладающих высоким метастатическим потенциалом [2]. Около 75% больных к моменту начала специального лечения уже имеют распространенный процесс [1; 9]. Развитие меланомы – сложный процесс, в который вовлечены различные факторы. В 75% случаев МК возникает из отдельных кожных меланоцитов, а в 25% – из предсуществующих невусов [6-8]. Некоторые исследователи рассматривают всю совокупность меланоцитов организма как своеобразную эндокринную или цитокринную меланогенную систему, ответственную за выработку пигмента. Степень функционирования этой системы организма во многом зависит от факторов внешней среды (прежде всего уровня инсоляции) и регулируется продукцией меланостимулирующего гормона, вырабатываемого передней долей гипофиза. В клинической практике внимание уделяется признакам активизации невусов, которые свидетельствуют об усилении пролиферативной активности клеток невуса или даже его малигнизации [3; 5]. Считается, что диспластический невус является недостающим звеном между доброкачественным и злокачественным меланоцитарным поражением. С другой стороны, диспластические невусы десятилетиями остаются без изменений, и для их малигнизации нужны дополнительные генетические нарушения [10]. За последнее десятилетие, начиная с 2002 г., когда была открыта мутация BRAF, достигнут значительный прогресс в изучении молекулярных механизмов канцерогенеза меланомы. Так, мутации NRAS обнаруживают в 94,7% случаев врожденных меланоцитарных невусов, которые характеризуются повышенным риском трансформации в меланому [3]. Способность опухолевых клеток к инвазии в ткань дермы является критическим событием в развитии меланомы кожи и в итоге индикатором плохого прогноза для пациентов. Изучение некоторых молекулярно-биологических параметров меланоцитарных образований кожи и молекулярных процессов, связанных с приобретением инвазивного фенотипа, может способствовать раскрытию новых звеньев патогенеза меланомы и поиску дополнительных диагностических критериев.
Цель исследования
Изучить экспрессию некоторых молекулярно-биологических маркеров, контролирующих апоптоз (р53), пролиферацию (ki-67), ангиогенез (CD31, VEGF) в ткани меланоцитарных образований кожи.
Материал и методы исследования
В исследование были включены 15 больных в возрасте от 21 до 49 лет с пигментными доброкачественными образованиями, включая 5 больных с диспластическими невусами. Невусы, взятые для исследования, располагались на коже туловища, конечностей, лица и шеи. Их размеры по длине колебались от 5 до 25 мм, по ширине – от 2 до 18 мм, по толщине – от 2 до 8 мм. И 11 больных с меланомой кожи. Меланомы, взятые для исследования, располагались на коже спины и нижних конечностей. Их размеры по длине колебались от 1,3 до 8,5 мм, по ширине – от 1,0 до 2,5 мм, при поверхностно-распространяющейся меланоме, толщина по Бреслоу составила от 1,3 до 7,0 мм, при узловой меланоме кожи толщина по Бреслоу – от 1,0 до 3,5 мм, уровень инвазии по Кларку составил от II до IV.
Иммуногистохимическое исследование проводили на срезах с парафиновых блоков, предназначенных для стандартного морфологического исследования, с помощью моноклональных антител ki-67, р53, CD31, VEGF. Использованные в работе первичные антитела и их разведения представлены в таблице.
Панель использованных в исследовании антител
Специфичность | Клон | Фирма | Разведение | Буфер для «демаскировки антигенов» |
Антиген ki-67, пролиферативная активность (ядерное окрашивание) | SP6 | Thermo scientific | 1:200 | 10 мМTris, 1 мМ EDTA (рН 6,0) |
Нормальный и мутантный тип p53 (ядерное окрашивание) | DO-7 | CELLMARQUE | 1:150 | 10 мМTris, 1 мМEDTA (рН 8,0) |
CD31/PECAM-1 Ab-6 (мембранное окрашивание эндотелиальных клеток) | 1A10 | Thermo scientific | 1:100 | 10 мМTris, 1 мМEDTA (рН 6,0) |
VEGF Ab-7 (стимулятор ангиогенеза) | VG1 | Thermo scientific | 1:150 | 10 мМTris, (рН 8,0) |
Депарафинизацию и регидратацию проводили по стандартной методике, «демаскировку» антигенов в PT-Link Thermo. Протокол включал в себя предварительный нагрев до 65 °C, восстановление антигена в течение 20 минут при температуре 97 °C и дальнейшее охлаждение до 65 °C. Затем стёкла промывали в течение 1–3 минут TBSIHCWashBuffer (CELLMARQUE) и помещали в иммуноавтостейнер Thermo Scientific для окрашивания в автоматическом режиме. Для визуализации иммуногистохимической реакции использовали систему детекции Ultra Vision Quanto Detection System HRPDAB. Срезы докрашивали гематоксилином Майера, для заключения использовали бальзам Bio-Mount. Оценку экспрессии маркеров изучали как минимум на 10 случайно выбранных полях зрения с применением светового микроскопа Zeiss Primo Star под увеличением х10, х40.
В исследовании применяли следующие критерии оценки маркеров:
1) опухоль считали отрицательной по р53, если в ткани опухоли отсутствовала ядерная реакция с антителами или количество окрашенных клеток было менее 25%, и положительной по р53, если было окрашено более 25% ядер опухолевых клеток;
2) для оценки пролиферативной активности (ПА) подсчитывали количество ki-67-положительных клеток, приходящихся на 200–300 опухолевых клеток. Индекс ki-67 определяли по формуле:
ПА= число ki-67 положительных клеток х 100/общее количество клеток.
Маркеры пролиферативной активности расценивали на основе наиболее часто употребляющегося способа оценки пролиферативной активности: 0–20% – низкая пролиферативная активность, 21–50% – умеренная пролиферативная активность, 51 –100% – высокая пролиферативная активность;
3) опухоль считали положительной по VEGF (VEGFопухоль+), если окрашено более 25% опухолевых клеток. Мы также в каждом конкретном случае количественно подсчитывали долю клеток (в%), окрашенных антителами к VEGF;
4) для оценки ангиогенеза использовали индекс внутриопухолевой микрососудистой плотности (intratumormicrovesseldensity – MVD). Микрососуды окрашивали антителом CD31. Количество сосудов определяли в каждом поле зрения препарата при использовании объектива х40 с использованием программы AxioVs40 v-4.8.1.0. Статистический анализ результатов исследования проводился с помощью программы STATISTICA 7.0 (StatSoftInc., США) и MedCalc (версия 9.3.5.0).
Результаты исследования и их обсуждение
Наиболее ранними событиями в процессах канцерогенеза и прогрессирования опухолей являются нарушение механизмов пролиферации и апоптоза в опухолевых клетках. На этой стадии теряются нормальные механизмы контроля клеточного деления и апоптоза. Способность к неограниченному размножению является одной из главных особенностей опухолевых клеток. Одним из методов определения пролиферативной активности (ПА) опухоли служит индекс ki-67-положительных клеток. При оценке пролиферативного потенциала меланоцитарных образований выявлено наличие умеренной пролиферативной активности ki-67у 11 больных (100%) меланомой кожи и у 5 (33,3%) с невусами, которые были определены как диспластические. Низкая пролиферативная активность отмечалась у 66,7% (10) больных с доброкачественными образованиями и отсутствовала у больных меланомой. Высокая пролиферативная активность в нашем исследовании не встречалась ни в одной из исследуемых групп. Доля пролиферирующих ki-67-положительных клеток в группе больных меланомой находилась в пределах от 30 до 45% клеток, в среднем составив 38,3 ± 3,6%. В группе доброкачественных образований доля ki-67-позитивных клеток находилась в пределах от 4 до 25%, где их среднее содержание составило 14,9 ± 1,2%, причем доля пролиферирующих клеток в диспластических невусах была максимальной и составляла 20-25% (рис. 1).
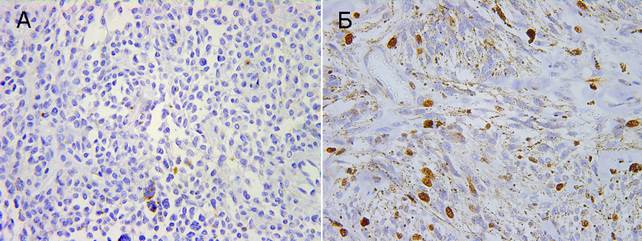
Рис. 1. Экспрессия ki-67. Ув. × 400. А – внутридермальный невус, Б – узловая меланома, веретеноклеточный вариант
Полученные нами данные, так же как и литературные, подтверждают, что иммунореактивность ki-67 хорошо коррелирует с доброкачественностью или злокачественностью меланоцитарных поражений и может помочь в дифференциальной диагностике доброкачественных невусов от меланом [9].
Другим не менее важным маркером биологического потенциала клеток является белок р53, который выполняет три основные функции: регуляцию клеточного цикла, индукцию апоптоза (в случаях, когда повреждения ДНК клетки не могут быть репарированы), стабилизацию генома. Нарушение регуляции клеточного цикла, связанное с изменением активности р53, ведет к развитию и прогрессированию злокачественного процесса. Мутации гена p53 ведут к «сверхэкспрессии» этого белка, которые иммуногистохимическим методом выявляются с помощью анти-р53 антител. Считается, что иммуногистохимическая положительная реакция полностью зависит от наличия мутантного типа р53 [4]. Экспрессия р53 в ядрах опухолевых клеток меланомы составила 22,0 ± 2,1%, тогда как в клетках невусов 2,1 ± 0,2% (различия статистически достоверны, р< 0,05). Положительная экспрессия р53 (>25%) наблюдалась у 54,5% (6) пациентов с меланомой кожи, тогда как в группе с невусами данная экспрессия не была отмечена. В основном преобладала единичная экспрессия р53в клетках невусов – 66,7% (10). У пациентов с меланомой разброс количества окрашенных клеток находился в пределах от единичного окрашивания до 35% клеток, и в 18,2% (2 из 11) достиг точки разделения cut-off в 25% ядер опухолевых клеток (рис. 2).
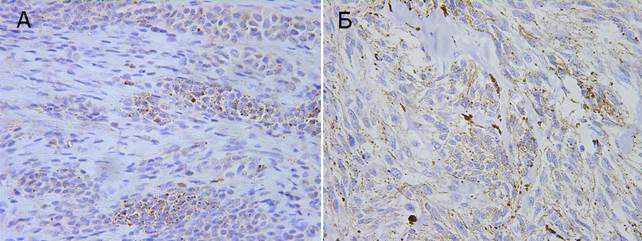
Рис. 2. Экспрессия p53. Ув. × 400. А – внутридермальный невус, Б – узловая меланома, веретеноклеточный вариант
Ангиогенез, как необходимая стадия в развитии новообразований, является сложным процессом, в который включено взаимодействие стромальных и опухолевых клеток. В индукцию ангиогенеза включены опухолеассоциированные макрофаги, которые имеют диагностическое и прогностическое значение при некоторых опухолях. VEGF занимает позицию главного митогена эндотелиальных клеток, и его присутствие требуется для образования незрелых сосудов при васкулогенезе или неоангиогенезе. Именно он и заставляет кровеносную систему организма закладывать новые сосуды, пронизывающие опухоль и образующие в ней разветвлённую сеть. Плотность микрососудов, которая отражает количество/объём образования новых сосудов, значительно больше в ткани, поражённой раком, чем в здоровой, и она находится в определённом соотношении с распространением опухоли. Важным показателем развития опухолевой прогрессии является микрососудистая инвазия опухоли, которую иммуногистохимически можно выявить с помощью антител к CD31. По уровню экспрессии CD31 производится подсчет плотности микрососудов в опухоли, которая является важным прогностическим признаком [4].
Экспрессия VEGF выявлена в цитоплазме клеток меланомы в 100% случаев (11), тогда как в доброкачественных образованиях – в 66,7% (10). Отсутствие экспрессии в клетках невусов отмечалось в 33,3% (5). Разброс окрашенных клеток антителами к VEGF и в меланомах, и в невусах очень неоднороден и составляет от менее 5% и до 50%. Нами выявлены достоверно значимые различия в экспрессии VEGF среди исследуемых групп, где среднее содержание клеток VEGF+ составило 32,5 ± 2,9%, тогда как в невусах 23,8± 2,1% (р<0,05).
При количественной оценке внутриопухолевой микрососудистой плотности выявлено, что среднее количество сосудов микроциркуляторного русла в поле зрения при меланоме и невусах составило 10,0±0,9 и 4,1±0,4 соответственно, результаты экспрессии CD31 статистически достоверны (р<0,05). Разброс количества сосудов, окрашенных CD31, в меланомах составил от 4 до 18 в одном поле зрения. В невусах в 12 случаях (80%) подсчитывалось не более 4, и только в гигантоклеточных невусах (3–20%) было отмечено до 15 сосудов в одном поле зрения (рис. 3).
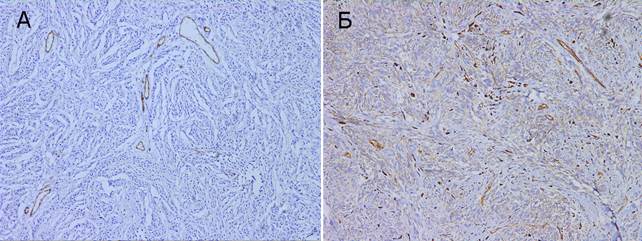
Рис. 3. Экспрессия p53. Ув. × 100. А – внутридермальный невус, Б – узловая меланома, веретеноклеточный вариант
Заключение
Проведенное исследование выявило ряд достоверных различий в экспрессии маркеров, контролирующих апоптоз, пролиферацию и ангиогенез в тканях доброкачественных и злокачественных меланоцитарных образований кожи. При оценке пролиферативного потенциала МОК выявлено наличие умеренной пролиферативной активности ki-67 у 11 больных (100%) МК и у 5 (33,3%) с диспластическими невусами. Положительная экспрессия р53 (>25%) наблюдалась у 6 (54,5%) пациентов с МК, тогда как в группе с невусами данная экспрессия не была отмечена. Нами выявлены достоверно значимые различия в экспрессии VEGF среди исследуемых групп, где среднее содержание клеток VEGF+ составило 32,5 ± 2,9%, тогда как в невусах 23,8 ± 2,1% (р<0,05). При оценке внутриопухолевой микрососудистой плотности выявлено, что среднее количество сосудов микроциркуляторного русла в поле зрения при меланоме и невусах составило 10,0±0,9 и 4,1±0,4 соответственно, результаты экспрессии CD31 статистически достоверны (р<0,05). Таким образом, изучение некоторых иммуногистохимических особенностей меланоцитарных образований кожи, определяющих инвазивный потенциал клеток, может способствовать разработке новых стратегий диагностики, прогнозирования и лечения меланоцитарных образований кожи.
Библиографическая ссылка
Новикова И.А., Максимова Н.А., Позднякова В.В., Максимова М.И., Ильченко М.Г., Ульянова Е.П., Гранкина А.О. НЕКОТОРЫЕ ИММУНОГИСТОХИМИЧЕСКИЕ ОСОБЕННОСТИ МЕЛАНОЦИТАРНЫХ ОБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2016. – № 5.;
URL: https://science-education.ru/ru/article/view?id=25132 (дата обращения: 17.10.2019).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Факторы определяющие степень злокачественности меланомы.Количество митозов в дермальном компоненте опухоли, особенно их число на 1 мм2 площади, является важным прогностическим фактором для меланомы. Митотическая активность выше, чем 6 митозов на 1 ммг, измеренная в компоненте вертикальной стадии роста опухоли, является фактором высокой степени риска. Можно использовать прогностический индекс (pi) для меланомы, который вычисляется путем умножения числа митозов, приходящихся на 1 мм2 площади опухоли, на показатель толщины опухоли в миллиметрах. Это более точный показатель прогноза для пациента, чем любая из этих двух переменных в отдельности. Изъязвление меланомыИзъязвление эпидермиса над дермальной частью опухоли — важная прогностическая переменная. Фактически в нескольких исследованиях она была представлена как независимый фактор прогноза. Но не все исследователи согласны с этим выводом. Изъязвление появляется в опухолях с достаточной глубиной инвазии для появления метастазов, но в проведенных исследованиях этот факт не учитывался. Однако в тех случаях, когда изучались опухоли, согласованные по толщине, сокращение периода выживания у пациентов с изъязвленными опухолями снизилось с 80 до 55%, при этом прогностическое значение имели изъязвления диаметром более 3 мм. Лимфоидная инфильтрация меланомыВ меланомах ответная реакция организма на неопластический процесс представлена, в основном, лимфоцитами. Опухоли с выраженным лимфоцитарной инфильтрацией имеют лучший прогноз. W.H. С1аrk с соавт. ввели термин TTLs («лимфоциты, инфильтрирующие опухоль»), чтобы учеств наличие лимфоцитов, фактически проникающих между клетками опухоли, что особенно важно для вертикальной стадии роста опухоли. В своих исследованиях они не относили к TILs лимфоциты, инфильтрирующие строму опухоли, и лимфоциты, связанные с радиальной стадией роста меланомы. Посредством многофакторного анализа эти ученые установили, что TILs является вторым наиболее важным прогностическим фактором для стадии I и II, а опухоль с оживленным TILs-ответом имеет более благоприятный исход. Отсутствие иммунного ответа в опухолях толщиной 3,65 мм и более служит отрицательным прогностическим фактором в отношении выживания больных и положительным в отношении вероятности развития костных и висцеральных метастазов. Регрессия меланомыОдин из уникальных аспектов меланомы — способность опухоли к спонтанной регрессии. Регрессия может быть частичной или полной. Сложившиеся противоречия вокруг понятия «спонтанной регрессии» в меланоме как прогностического фактора являются результатом использования различных определений самой «регрессии». Регрессия может проис-ходитв как в радиальной, так и в вертикальной стадии роста. Однако именно регрессия при радиальной стадии роста исторически была изучена как потенциальный прогностический признак меланомы. Эта регрессия была определена как отсутствие элементов опухоли в эпидермисе. Участок регрессии характеризовался фиброзом сосочкового слоя дермы, повышенной васкуляризацией и смешанной инфильтрацией лимфоцитами и меланофагами. Регрессия описывалась как «ак-ивная», когда присутствовали TILs, и как «прошлая», когда все клетки опухоли исчезали. Полное исчезновение клеток опухоли можно определить и как «истинную» регрессию. Несколько групп исследователей наблюдали неблагоприятные результаты у пациентов с частичной регрессией опухоли, в то время как другие не отмечали подобных результатов. W.H. Clark и соавт. предположили, что регрессия при радиальной стадии роста опухоли является важным независимым фактором прогноза выживания, но только у пациентов с наличием компонента вертикальной стадии роста. Невозможно предсказать прогноз у пациентов, если опухоль полностью регрессировала, или у пациентов, имевших только радиальную стадию роста опухоли, потому что статистически последние имеют выживание в 100% случаев, независимо от присутствия регрессии или любого другого прогностического фактора.
Гистологический подтип меланомыИсторически сложилось, что подтип меланомы (злокачественное лентиго, поверхностно распространяющаяся или узловая меланома и т.д.) рассматривается как важный прогностический фактор, однако он не является независимым фактором прогноза. Так, неблагоприятный прогноз при узловой меланоме связан с толщиной опухоли, а не с гистологическим подтипом. Узловая меланома — по определению, опухоль в вертикальной стадии роста, в среднем ее толщина больше, чем при других гистологических подтипах, которые классифицируются на основании присутствия компонента радиальной стадии роста. Меланома типа злокачественного лентиго — единственная форма, имеющая лучший прогноз, чем другие подтипы. Неточный состав компонента вертикальной стадии роста меланомыВсе меланомы имеют области, содержащие эпителиоидные и веретенообразные клетки, хотя в большинстве случаев отдельный клеточный тип преобладает. Меланомы, состоящие из веретенообразных клеток, имеют лучший прогноз, но при анализе клеточный состав редко рассматривается как независимый фактор прогноза. Плоидностъ Проточная цитометрия для определения плоидности клеток применялась и при изучении меланом. В результате установлено, что анеуплоидность постоянно коррелирует с толщиной, уровнем инвазии и изъязвлением и является независимым фактором риска развития рецидива для опухолей толщиной более 1,5 мм и менее 3,0 мм. Анеуплоидность клеток также связана и с короткой ремиссией. Komino с соавт. выявили, что анеуплоидность может обнаруживаться в маленьких меланомах (и менее 6 мм) и уже на этой стадии связана с высоким риском рецидивирования и метастазирования. Маркеры пролиферации меланомыМитотическая активность в меланомах связана с рецидивами и выживанием. Иммуногистохимическое выявление высокого показателя пролиферации Ki-67 (MIBl) в меланомах коррелирует с толшиной опухоли. Толшина опухоли и максимальная числовая плотность Ki-67-положительных ядер является независимым фактором прогноза, более существенным по своему значению, чем толщина опухоли или число митозов по отдельности. Рецепторы эстрогена Поскольку существуют явные различия в анатомическом местоположении и биологическом поведении меланом у мужчин и женщин, была исследована роль эстрогена и его рецепторов в меланомах. Меланомы имеют способность закрепления гормона стероида, однако не все исследования до настоящего времени сумели подтвердить наличие белка эстроген-рецептора в меланомах, даже в течение беременности. Тем не менее Walker с соавт. выявили наличие белка рецептора в 37-50% меланом как у мужчин, гак и у женщин и определили его как фактор прогноза, наряду с толшиной опухоли и уровнем инвазии. Присутствие и роль эстроген-рецепторов в меланомах требуют дальнейшего изучения. – Также рекомендуем “Стадийная классификация меланом кожи.” Оглавление темы “Виды меланом. Прогноз при меланоме.”: |
Источник