Генотип впч не обнаружен

Вирус папилломы человека считается одним из наиболее распространённых заболеваний, включающих в себя более 100 различных типов. Большинство из них малоопасны для человека и при хорошем состоянии организма могут быть нейтрализованы работой иммунной системы. Однако существуют штаммы ВПЧ, вызывающие серьезные кожные поражения и отличающиеся высоким уровнем онкогенности:
 Для выявления типов вируса существует процедура генотипирования, позволяющая не только диагностировать наличие инфекции, но и дать прогноз относительно развития заболевания. Благодаря этой процедуре лечащий врач может подобрать тактику лечения, подходящую для конкретного типа.
Для выявления типов вируса существует процедура генотипирования, позволяющая не только диагностировать наличие инфекции, но и дать прогноз относительно развития заболевания. Благодаря этой процедуре лечащий врач может подобрать тактику лечения, подходящую для конкретного типа.
Что это такое
Под «генотипированием» понимается не конкретная процедура, а ряд диагностических мер, нацеленных на определение типа ВПЧ, концентрации вируса в организме. Тесты могут определить сразу несколько штаммов, что характерно для подобной инфекции. В таком случае обычно говорят о более сложном течении болезни.
Обычно диагностика не ограничивается только генотипированием: лечащим врачом также проводится внешний осмотр, при необходимости сдаётся кровь, у женщин выполняется кольпоскопия и т.д. Однако именно генотипирование является основным способом определить наличие ВПЧ. Такой метод очень чувствителен к минимальным изменениям в концентрации вируса, поэтому легко позволяет выявить отклонения.

Определение типа ВПЧ
Процедура диагностики проводится в несколько этапов. После консультации врачу необходимо подтвердить наличие вируса, и только после этого проводится типирование. Перед самим тестом пациенту предстоит пройти несколько процедур:
После подтверждения присутствия ВПЧ в организме врачом может быть назначен мазок или соскоб, необходимый для теста ПЦР.

В случае если инфекция уже проявила себя в виде новообразований, дополнительные методы диагностики обычно не применяются. В зависимости от обнаруженных вирусных штаммов назначается специфическое лечение, обычно включающее в себя удаление имеющихся наростов.
Особенности типов вируса
Все типы папилломавируса делятся на несколько больших групп, исходя из степени онкогенности, т.е. риска развития злокачественных новообразований. Чем более высокая степень, тем большему риску подвергается больной с уже имеющимися доброкачественными папилломами. Выделяют следующие классификации HPV (обозначение ВПЧ в анализах):
- Высокоонкогенные. Риск развития злокачественной опухоли в пораженной области очень высок. К таким типам HPV относятся 16, 18, 31, 33, 45, 50 штаммы. Они обычно проявляются остроконечными кондиломами, образующимися в области половых органов больного.
- Среднеонкогенные. Развитие злокачественной опухоли происходит примерно в половине случаев среди всех инфицированных. В эту группу входят 26, 30, 35, 65 штаммы.
- Низкоонкогенные. Эти типы ВПЧ обычно проявляются в форме бородавок, что считается довольно безвредным, хоть и неприятным косметическим дефектом. К ним относятся 6, 11, 13, 32, 40 штаммы. Развитие раковых заболеваний с такими формами вируса практически невозможно.
Среди всех типов HPV больше всего выделяются 16 и 18 штаммы. Они представляют наибольшую опасности для женщин: в 80% случаев у больных раком шейки матки был диагностирован один из этих типов ВПЧ. Такие формы вируса считаются наиболее агрессивными, поэтому при диагностировании требуют незамедлительного лечения.
Способы диагностики
Для проведения диагностики пациент может обратиться к гинекологу, урологу, проктологу, дерматологу или даже к терапевту, если не уверен в природе появления своих наростов. Врач может дать первичное заключение, исходя из внешних признаков проявления вируса, однако для прояснения деталей назначаются разные типы исследований. К ним относятся:
- Кольпоскопия. Благодаря кольпоскопу гинеколог способен многократно увеличивать изображение, показывающее слизистую оболочку половых органов изнутри. Процедура позволяет детально рассмотреть влагалище и шейку матки, благодаря чему врач может заметить появление даже мелких новообразований. Особенности протекания ВПЧ таковы, что наросты могут образовываться даже на внутренних половых органах, поэтому исследование кольпоскопом является обязательным этапом диагностики.

- Цитология. Этот метод исследования основан на взятии мазка с пораженной оболочки места воздействия вируса. После забора мазок исследуется под микроскопом и проверяется на наличие злокачественных клеток. Результаты цитологии расшифровываются следующим образом: 1-2 группа говорит об отсутствии патологии, 3 показывает необходимость других исследований, так как диагноз под сомнением, 4-5 группа свидетельствует о наличии злокачественных изменений.

- Гистология. Для процедуры также берут частичку биоматериала с определенного участка тела, после чего данные исследуются под микроскопом. Отличие этого метода от предыдущего в том, что анализу подвергается не мазок, а небольшой кусочек нароста. Так можно более наглядно увидеть, происходят ли онкологические изменения на конкретном участке.

- ПЦР-диагностика. Один из наиболее распространенных анализов, основанный на взятии мазка из влагалища или уретры. Метод считается довольно чувствительным и позволяет выявить не только наличие вируса, но и определить конкретные штаммы. Также ПЦР тест используют для отслеживания концентрации вируса, что помогает увидеть, насколько эффективным было лечение.

- Digene test. Предназначен преимущественно для скрининговых обследований женщин, так как эффективно выявляет предраковое состояние. Материал для забора – мазок, взятый из влагалища. Также тест может использоваться в качестве дополнительного исследования, уточняющего результаты других тестов.

Каждый тест необходимо выполнять только под наблюдением специалиста. При несоблюдении правил проведения диагностики существует вероятность получения ложноположительного или ложноотрицательного результата, причем последний встречается чаще.
Видео от нашего практикующего дерматовенеролога:
Особенности обследования у мужчин и женщин
Принцип действия каждого теста генотипирования одинаков и основан на заборе небольшого количества клеток с пораженного места. Различается только способ забора материала. Женщины обычно сдают на анализ соскоб, берущийся из шейки матки. Такой материал считается самым информативным, в отличие от соскоба из влагалища. Для этого врач берет небольшую щетку, щетинки которой предназначены специально для забора материала из цервикального канала.

После этого материал отправляется на изучение в лабораторию. Такая манипуляция не должна причинять женщине неудобства. Единственным противопоказанием для неё является наличие менструации.
Материал для изучения у мужчин берется из уретры. С помощью небольшого зонда врач берет соскоб эпителия, который после извлечения остается на специальном стекле. В таком виде анализ отправляется на исследование. При диагностике ВПЧ мужчинам обычно назначают тест ПЦР.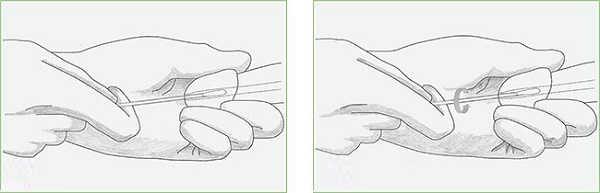
Принцип лечения
Полное излечение пациента от папилломавируса невозможно даже при грамотном, своевременно назначенном лечении. ВПЧ всегда будет присутствовать в организме в скрытой форме и сможет проявить себя в виде рецидива на фоне сильного стресса или ослабленного иммунитета. Поэтому принципы терапии основаны не на полном излечении инфекции, а на минимизировании последствий инфицирования. В рамках терапии для этого используется:
- удаление всех новообразований (конкретный способ пациенты должны обговаривать с лечащим врачом, так как разные типы наростов требуют разных подходов);
- применение иммуностимулирующих средств;
- назначение противовирусных препаратов.
В совокупности все эти методы помогают держать под контролем концентрацию вируса в организме, а регулярное генотипирование отслеживает вирусную нагрузку.
Лечение важно проводить исключительно под контролем врача, так как необходимо смотреть на реакцию организма, которому могут не подойти назначаемые лекарства. Домашнее самолечение в виде прижигания папиллом, использование чистотела и т.д. может оказаться очень опасным. Больной может не знать, что его новообразование переродилось в злокачественное, а самостоятельная попытка удалить раковые клетки может привести к летальному исходу.
Цена на анализы
Стоимость процедур зависит от места проживания и может существенно разниться от региона к региону. Усредненные цены на диагностику вируса выглядят следующим образом:
- количественный ПЦР тест с определением 12 генотипов вируса – 600-800 рублей;
- идентификация отдельно взятых штаммов ВПЧ – 250-350 рублей;
- кольпоскопия – 900-1400 рублей;
- цитология – 700-1200 рублей;
- Digene-тест на определение высокоонкогенных штаммов вируса – 5000-6000 рублей;
- гистологическое исследование – 2000-3000 рублей.
Подбирать способ диагностики больному следует совместно с лечащим врачом, так как каждая ситуация требует индивидуального рассмотрения. Кроме того, необходимо через некоторое время повторно провести диагностику для анализа качества проведенного лечения.
Источник
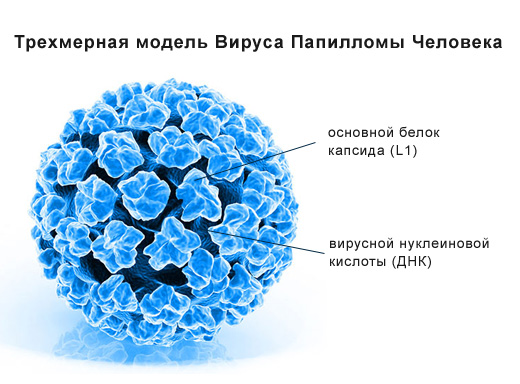
Папилломавирус человека (ВПЧ), Human papillomavirus (HPV) принадлежит к семейству паповавирусов (Papovaviridae), роду папилломавирусов. Это ДНК-содержащий мелкий вирус, термостабильный. Является самой распространенной инфекцией, передающейся половым путем: по некоторым данным, в молодом возрасте отмечается инфицирование до 80% населения. Вирус проявляет тропность к эпителию кожи, слизистых оболочек гениталий и других органов (гортань, ротовая полость, слизистая конъюнктивы).
Основной путь передачи — половые контакты, включая анальный, оральный секс, к сожалению, использование презервативов не защищает от инфицирования данным вирусом. Возможна передача при тесном контакте кожи, слизистых оболочек с инфицированными областями. Важным фактором инфицирования новорожденного с последующим развитием респираторного папилломатоза гортани является инфицирование при прохождении по половым путям во время родоразрешения. На сегодняшний день известно более 100 видов вируса папилломы человека (ВПЧ) и из них более 40 могут вызвать поражение аногенитального тракта (половые органы и задний проход) мужчин и женщин и появление остроконечных кондилом. Папилломавирусы можно разделить на 3 основные группы:
неонкогенные ВПЧ (1, 2, 3, 5 генотипы);
низкого канцерогенного риска (НКР) ВПЧ (6, 11, 42, 43, 44 генотипы);
высокого канцерогенного риска (ВКР) ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 генотипы).
ВПЧ низкого канцерогенного риска (ВПЧ НКР): группа вирусов, которая приводит к доброкачественным поражениям, представлена 5 генотипами, но основными являются 6 и 11, которые составляют до 90% всех случаев инфицирования данными вирусами. Наиболее частые клинические проявление ВПЧ НКР- это остроконечные кондиломы (Condylomata acuminata). Также выделяют еще разновидности остроконечных кондилом: кератотические бородавки с локализацией на сухой коже, папулезные бородавки с локализацией на полностью ороговевшем эпителии, гигантская кондилома Бушке-Левенштейна (встречающаяся у больных сниженным клеточным иммунитетом или при беременности). Эндоуретральные кондиломы локализуются в уретре, часто сочетаются с обычными кондиломами и встречаются преимущественно у мужчин. Кондиломы шейки матки часто сочетаются с генитальными кондиломами: экзофитные кондиломы, эндофитные (плоские).
ВПЧ высокого канцерогенного риска (ВПЧ ВКР): группа типов высокого канцерогенного риска представлена 15 генотипами, наиболее распространенными из которых являются десять: 16, 18, 31, 33, 35, 39, 45, 52, 58, 59. При этом на долю 16 и 18 типов приходится 70% всех случаев инфицирования, и именно данные типы характеризуются высоким канцерогенным потенциалом, в отношении 18 генотипа наблюдается высокая частота выявления при аденокарциномах. На сегодняшний день доказана роль ВПЧ в развитии рака шейки матки, большей доли рака заднего прохода (около 90% случаев), около 40% всех случаев рака влагалища, вульвы, полового члена, 10–15% случаев рака ротовой полости и гортани.
Вирусная ДНК способна персистировать в клетке в двух формах: эписомальной (продуктивная стадия) и интегрированной (интегрированная стадия). На эписомальной стадии происходит усиленная продукция новых вирусов, что способствует вовлечению в патологический процесс новых клеток, однако клетки не теряют контроль над процессами апоптоза и эта стадия характеризуется доброкачественными изменениями со стороны эпителия. Интегрированная стадия — это стадия, когда вирус встраивается в геном клетки и приводит к суперэкспрессии онкобелков Е6, Е7, ассоциируется с предраковыми изменениями и требует соответствующей тактики лечения пациента.
Инфекция, вызываемая вирусом папилломы человека, имеет ряд важных особенностей, без учета которых использование ВПЧ-тестирования сопряжено с рядом трудностей в трактовке результатов.
С одной стороны:
ВПЧ является самой распространенной ИППП (до 80% лиц молодого возраста инфицированы данным вирусом);
при инфицировании большинство женщин (около 80%) излечиваются от ВПЧ в течение 9–15 месяцев от момента заражения без проведения лечебных процедур (т. е., при повторении теста на генотипирование через год возможно исчезновение выявленного ранее генотипа ВПЧ или изменение спектра генотипов). С возрастом способность к самоэлиминации значительно снижается;
инфицирование ВПЧ и заболевание — НЕ СИНОНИМЫ! Инфекция приводит к развитию предрака у малой части инфицированных женщин (около 0,5%);
от заражения до развития предрака и РШМ, в среднем, проходит 10–20 лет. С возрастом способность к элиминации вируса снижается, соответственно, повышается риск развития предрака и рака;
отсутствуют эффективные методы лечения на стадии латентной инфекции (нет изменений в цитологической и/или кольпоскопической картине, но выявляется вирус).
С другой стороны:
ВПЧ является основной причиной рака шейки матки. Инфицированные женщины имеют в 300 раз более высокий риск развития рака. Разработаны не только методы вторичной профилактики (цервикальный скрининг для выявления предраковых стадий), но и первичной — вакцинация девочек и мальчиков в возрасте 9–12 лет;
инфекция коварна и довольно часто не вызывает никаких жалоб у пациента и не выявляется при осмотре до перехода в стадию инвазивного рака;
клинические проявления папилломавирусной инфекции высокого риска могут маскироваться другими заболеваниями урогенитального тракта, что не позволяет вовремя выявить их с использованием традиционных методов.
Из перечисленных особенностей папилломавирусной инфекции следует, что:
1. Положительный результат тестирования на наличие вируса должен трактоваться как:
принадлежность пациента к группе высокого риска по развитию рака шейки матки;
потребность в дополнительных тщательных диагностических процедурах для выяснения текущей стадии инфекции, исключения тяжелой дисплазии и рака шейки матки;
необходимость в наблюдении за инфекцией (персистенцией) при отсутствии клинических или субклинических проявлений.
2. Отрицательный результат тестирования трактуется как отсутствие риска развития тяжелой дисплазии и рака.
Лабораторная диагностика. Диагностика ВПЧ инфицирования определяется клиническими проявлениями и клиническими задачами прогноза риска развития ВПЧ-ассоциированных злокачественных новообразований.
Лабораторные методы диагностики ВПЧ инфекции:
прямые методы: оценка наличия койлоцитов в цитологических мазках (низкая диагностическая чувствительность); выявление наличия маркеров пролиферации р16/ki 67; молекулярные методы (ПЦР анализ), которые проводятся в формате качественного и количественного тестирования с возможностью генотипирования, определение генотипов НКР и ВКР ВПЧ;
серологические методы не используются для диагностики ВПЧ инфекции.
Стратегии использования ВПЧ-тестов в диагностике предрака и рака шейки матки:
входит в комплекс цервикального скрининга: в качестве теста сортировки патологических ПАП тестов у женщин до 30 лет; тест совместно с цитологическим исследованием для всех женщин старше 30 лет. В данном случае наличие инфицирования ВПЧ (особенно, 16 и 18 генотипом, с высокой вирусной нагрузкой) позволяет прогнозировать высокий риск наличия или развития РШМ, что определяет необходимость дополнительных обследований. В случае отрицательных результатов ВПЧ тестирования, периодичность скрининга может быть увеличена до 3–5 лет (в разных странах действуют различные рекомендации) при условии отсутствия изменений в цитологическом исследовании;
рекомендован в некоторых странах как тест первичного скрининга на РШМ у женщин старше 30 лет;
контроль эффективности лечения дисплазий (первое исследование проводится через 6 месяцев после лечения совместно с ПАП тестом). При этом в случае получения положительных результатов ВПЧ теста и нормальной цитологии, необходимо дополнительное обследование, т. к. риск наличия или развития патологии высокий.
Различные методы молекулярной диагностики (ПЦР анализа) позволяют решить различные диагностические задачи:
качественный формат позволяет выявить наличие инфицирования, однако не позволяет оценить клинически значимые количества вируса, которые ассоциируются с высоким риском наличия предраковых поражений;
количественный формат позволяет выявить вирус, определить вирусную нагрузку. Это позволяет оценить не только степень риска, но и возможное уже наличие предраковых изменений, т. к. высокая вирусная нагрузка ассоциируется с реализацией онкогенного потенциала вируса. При правильном и стандартизированном заборе клинического материала вирусная нагрузка менее 105 геномных эквивалентов (ГЭ) ВПЧ ВКР в соскобе (Josefsson et al, 2000; van Duin et al, 2002; Dalstein et al, 2003; Snijders et al, 2003; Moberg et al, 2004, 2005) или 103 ГЭ приходящихся на 100 тыс. клеток человека считается клинически малозначимой, так как практически не встречается при тяжелой дисплазии и РШМ, а также ассоциирована с минимальным риском их развития. Напротив, количество вируса более 105 ГЭ, приходящихся на 100 тыс. клеток при установленном факте персистентного течения инфекции (ВПЧ выявляется более 1 года), обозначается как повышенная нагрузка ВПЧ и ассоциировано с повышенным риском развития тяжелой дисплазии и чаще встречается при РШМ. Наконец, определенной информацией обладает мониторинг вирусной нагрузки. Так, считается, что снижение количества ДНК ВПЧ более чем на 1 lg может являться маркером транзиторной инфекции. Рост вирусной нагрузки через 3, 6 и 9 мес. после проведенного лечения свидетельствует о возможности рецидива.
Генотипирование ВПЧ дает дополнительные возможности определения прогноза течения заболевания. Необходимость генотипирования может быть оправдана, т. к.:
выявление нескольких генотипов вируса ассоциировано с менее благоприятным прогнозом течения заболевания и более высоким риском персистенции;
степень онкогенности различных генотипов высокого риска не одинакова. Наибольшей онкогенностью обладают 16 и 18 типы ВПЧ, существуют рекомендации по проведению определения этих двух генотипов вируса после теста на широкий спектр типов с целью более агрессивной тактики ведения пациентов: при выявлении 16 и 18 генотипов рекомендуется сразу проводить кольпоскопическое обследование, при выявлении других типов высокого риска — сначала проводить цитологию, и только при положительном результате цитологии проводить кольпоскопию;
проведение генотипирования позволяет отличить реинфицирование от персистирования инфекции при повторном визите пациента. Получать подобную информацию тем более важно, так как опасность представляет именно хроническая персистентная форма инфекции, недавнее же инфицирование, наиболее вероятно, спонтанно излечивается. О реинфицировании говорит изменение спектра генотипов, о персистирующей инфекции — сохранение генотипа вируса через год после первого тестирования; повторное инфицирование тем же генотипом вируса после самостоятельного излечения практически невозможно.
Источник