Вакцина против меланомы собак
Кузнецова А.Л., к.б.н., Шимширт А.А., Федотова О.Ю.
Клиника экспериментальной терапии ФГБУ «РОНЦ им. Н.Н. Блохина РАМН», ООО «Биоконтроль»
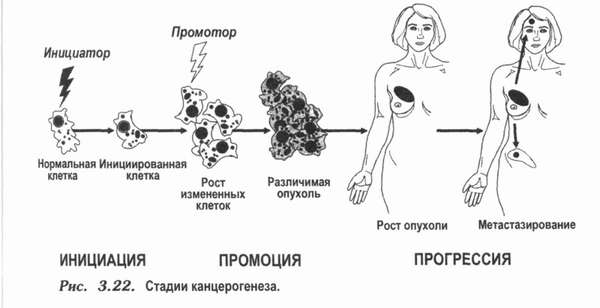
Несмотря на успехи в хирургическом, и радиологическом лечении меланомы в ветеринарной медицине это заболевание по-прежнему остается фатальным и средняя продолжительность жизни у животных с меланомой 3 стадии на фоне лечения, как правило не превышает 4-6 мес (Withrow S.J., David M., 2007). Уже достаточно давно известно, что меланома является иммуногенной опухолью т.е. экспрессирующей так называемые опухолеассоциированные антигены, и поэтому может служить хорошей моделью для изучения ответа иммунной системы на применение биологически активных препаратов (иммунизация, вакцинация) Клинические испытания показали, что вакцины безопасны в использовании и имеют намного меньшую токсичность, чем препараты, использующиеся для химиотерапии. (В.М. Моисеенко,2001)
Прогрессирование меланомы зависит от иммунных факторов, и стимулирование этих факторов при вакцинотерапии может увеличить сопротивление организма. Эту теорию подтверждают два наблюдения:
1) Частичная регрессия первичной меланомы
В естественных условиях иммунная система способна идентифицировать и селективно уничтожать клетки меланомы. Об этом свидетельствуют спонтанные частичные регрессии меланомы у человека в 15% до 20% случаев первичных поражений, и редких случаях полной регрессии опухоли на поздних стадиях. В результате сложных иммунных реакций происходит избирательное поражение клеток меланомы, в то время как нормальные меланоциты не вовлекаются в иммунный ответ.
2) Профилактика меланомы у мышей с помощью вакцин
Известно, что перевивание интактным мышам клеток меланомы В16 приводи к 100% гибели животных в период от 6 до 8 недель. В то время как предварительная вакцинация животных увеличивает выживаемость до 80%. При проведении Защита является специфической для меланомы (By Jean-Claude Bystryn, MD, Sandra R. Reynolds, PhD, 2005).
Важными событиями для понимания развития противоопухолевого иммунитета при вакцинотерапии меланомы стали: (1) понимание презентации антигена и роль активация Т-лимфоцитов в создание противоопухолевого иммунного ответа ответ, (2) определение количества меланома-специфических опухолевых антигенов, которые являются общими для опухолей у разных больных, и (3) открытие процесса расшифровки Т-лимфоцитами определенных пептидных фрагментов, адгезирующихся на поверхности мембран опухолевых клеток
Установлено, что вакцинотерапия после широкого хирургического удаления опухоли способствует увеличению продолжительности бессимптомного периода и отдаляет сроки рецидивирования злокачественных заболеваний. Кроме того, вакцинотерапия приводит к регрессии или стабилизации роста опухолей некоторых видов у пациентов с клинически определенными метастазами (Барышников А.Ю., 2004).
Университет ветеринарной медицины США штата Миссисипи предложил лечение собак с распространенной меланомой слизистой ротовой полости с помощью вакцинотерапии. Вакцина была разработана компанией Merial Limited и рекомендована к использованию в качестве составляющего компонента комплексной терапии у животных со II и III стадией меланомы слизистой ротовой полости совместно с широким хирургическим иссечением и/или лучевой терапией. Механизм действия вакцины основан на использовании человеческой тирозиназы, стимулирующей иммунный ответ у клеток меланомы собак (Jack С. F. et al., 2006).
Медиана выживаемости у собак с высокими стадиями меланомы слизистой ротовой полости, которых лечили традиционно (с применением хирургии или лучевой терапии) не превышала 5 месяцев (Withrow S.J., David M., 2007). Использование новой вакцины в клинических испытаниях привело к значительному увеличению медианы выживаемости до 389 дней (Deborah A. et al., 2011). Рекомендованный протокол лечения: подкожное или внутрикожное введение вакцины 1 раз в 2 недели в течение 2-х месяцев, затем вакцинацию повторяют 1 раз в 6 мес (P.J. Bergman, et al., 2006).
В период с 2013 по 2014 год в ветеринарной клинике «Биоконтроль» наблюдалось 2 животных с 3 стадией меланомы слизистой ротовой полости, которым проводилось комплексное лечение, включающее в себя комбинацию дистантной лучевой гамма-терапии и вакцинации по вышеуказанной схеме. Также 1 животному проводилась вакцинация при IV стадии заболевания (на момент вакцинации отмечались множественные метастазы в кожу и легкие). В результате проведенных наблюдений одна собака с 3 стадией меланомы прожила 144 дня и была эутаназирована по желанию владельцев в связи с прогрессированием основного заболевания. Другое животное находится на данный момент под наблюдением. На фоне проводимых манипуляций отмечается частичная регрессия первичного опухолевого очага на 35-40%. При контрольных рентгенографических и ультрасонографических исследованиях признаков прогрессирования не выявлено. Общее состояние пациента удовлетворительное. Общее время наблюдения на данный момент составило 189 дней от момента первичного обращения. Продолжительность жизни животного с IV стадией составила 28 дней. Клинического эффекта от вакцинотерапии зарегестрировано не было. Это может объясняться тем, что для формирования противоопухолевого ответа необходимо не менее 2-х месяцев от момента начальной вакцинации.
Таким образом, благодаря успехам в биотехнологии и молекулярной биологии появилась возможность конструировать и применять в клинической практике как в гуманной медицине, так и в ветеринарии противоопухолевые вакцины, способные индуцировать эффективный иммунный ответ у пациента. Можно ожидать, что интенсивный поиск эффективной противоопухолевой вакцины приведет к созданию технологического препарата, который займет достойное место в онкологической клинике.
Вакцины являются перспективным, но все еще экспериментальное лечение меланомы. Они призваны стимулировать иммунный ответ против меланомы и тем самым, повысить сопротивление и замедлить прогрессирование рака.
СПИСОК ЛИТЕРАТУРЫ
1. Барышников А.Ю. Принципы и практика вакцинотерапии рака , Билютень СО РАМН №2 (112) 2004;
2. P.J. Bergman, M.A. Camps-Palau, J.A. McKnight, N.F. Leibman, D.M. Craft, C. Leung, J. Liao, I. Riviere, M. Sadelain, A.E. Hohenhaus , P. Gregor, A.N. Houghton, M.A. Perales, J.D. Wolchok Development of a xenogeneic DNA vaccine program for canine malignant melanoma at the Animal Medical Center// Vaccine 24 (2006) 4582-4585
3. By Jean-Claude Bystryn, MD, Sandra R. Reynolds, PhD / Melanoma Vaccines: What We Know So Far// 2005.
4. Deborah A. Grosenbaugh, DVM, PhD; A. Timothy Leard, DVM, PhD; Philip J. Bergman, DVM, PhD; Mary K. Klein, DVM, MS; Karri Meleo, DVM; Steven Susaneck, DVM, MS; Paul R. Hess, DVM, PhD; Monika K. Jankowski, DVM; Pamela D. Jones, DVM; Nicole F. Leibman, DVM, MS; Maribeth H. Johnson, MS; Ilene D. Kurzman, MS, EdD; Jedd D. Wolchok, MD, PhD Safety and efficacy of a xenogeneic DNA vaccine encoding for human tyrosinase as adjunctive treatment for oral malignant melanoma in dogs following surgical excision of the primary tumor // AJVR, Vol 72, No. 12, December 2011
5. Jack С F. Liaol, Polly Gregor2,3, Jedd D. Wolchok2, Francesca Orlandi2, Diane Craftl, Carrie Leungl, Alan N. Houghton2, and Philip J. Bergman 1 Vaccination with human tyrosinase DNA induces antibody responses in dogs with advanced melanoma // Cancer Immunity, Vol. 6, p. 8 (21 April 2006)
6. O. Kilkuchi, Y. Akasaki, I. Irie et al. Results of a phase I clinical trial of vaccination of glioma patients with fusions of dendritic and glioma cells // Cancer Immunol. Immunother. 2001. Vol. 50. P. 337-344.
7. Karin U. Sorenmo, Erika Krick, Christina M. Coughlin3, Beth Overleyl, Thomas P. Gregor, Robert H. Vonderheide., Nicola J. Mason CD40-Activated В Cell Cancer Vaccine Improves Second Clinical Remission and Survival in Privately Owned Dogswith Non-Hodgkin’s Lymphoma, 2011
8. Withrow S.J., David M. Vail «Small animal clinical oncology» fourth edition, Saunders, an imprint of Elsevier Inc, 2007.
9. R. Yamanaka, O. Abe, N. Tajima et al. Vaccination of recurrent glioma patients with tumor lysateOpulsed dendritic cells elicits immune responses of a clinical phase I/II trial / R. Yamanaka, 0. Abe, N. Tajima et al. // British J. of Cancer. 2003. Vol. 89. P. 1172-1179.
10. J.S. Yu, C.J. Wheeler, D.I. Zeltzer et al Vacination of malignant glioma patients with peptide-pulsed dendritic cells elicits systemic cytotoxicity and intracranial T-cell infiltration // Cancer Res. 2001. Vol. 61. P. 842-847.
Источник
Текст статьи и фото 1-6 из руководства SMALL ANIMAL DERMATOLOGY A COLOR ATLAS AND THERAPEUTIC GUIDE 2017г
Перевод с англ.: ветеринар Васильев АВ
Особенности
Это состояние характеризуется доброкачественной (меланоцитома) или злокачественной (меланома) пролиферацией меланоцитов. Большинство случаев (85%) являются доброкачественными. Поскольку, у собак меланоцитомы и меланомы возникают на оволосенной коже или в оральной полости, то солнечное облучение не считается причинным фактором. Порода и семейная распостраненность у домашних животных наводит на мысль о том, что возможно существует генетическая предрасположенность к этой патологии.
Изменения в онкогенах, генах – супрессорах онкогенеза и иммунологическом надзоре также принимают участие в развитии этой патологии. Эти опухоли часто встречаются у пожилых собак и редко у пожилых кошек. Среди собак предрасположенные породы включают скотч терьеров, эрдельтерьеров, доберман пинчеров, кокер спаниелей, пуделей, ирландских сеттеров и щнауцеров.
Меланоцитомы обычно единичные, хорошо отграниченные, куполообразной формы, твердые, коричные или черные, безволосые, имеют ножку или бородавчатую форму и варьируют в размере от 0,5 до 10 см в диаметре. Могут также встречаться опухоли бляшковидной формы. Злокачественные меланомы могут быть пигментированными или непигментированными (амеланотичными), могут быть изьязвленными и имеют тенденцию быть более крупными и более быстро расти, чем доброкачественные меланоцитомы.
Злокачественные опухоли имеют тенденцию метастазировать сначала в региональные лимфоузлы и затем в легкие. Поражения могут находится на любом участке тела, но у собак они встречаются наиболее часто на голове, туловище и пальцах. У кошек поражения наиболее часто находятся на голове.
Диагноз
1 Цитология: округлые, овальные, звездчатые или веретенообразной формы клетки с умеренным количеством цитоплазмы, содержащей гранулы коричневого до зеленовато –черного пигмента. Злокачественные меланомы могут иметь меньше пигмента и демонстрировать более выраженный плейоморфизм, но злокачественность не может быть надежно установлена цитологически.
2 Дерматогистопатология: аккумуляция неопластических меланоцитов, которые могут быть веретенообразной, эпителиальной или округлой формы с различными степенями пигментации. Клетки могут группироваться в кластеры, шнуры, или завитки, подобные нервам. Часто наблюдается инфильтрация пигментными макрофагами. Доброкачественные опухоли отграничены и имеют низкую ядерную вариабельность и низкий митотический уровень.
Злокачественные меланомы могут показывать более выраженную инвазивность, более экстенсивный клеточный плейоморфизм и увеличенное количество митотических фигур (включая атипичные митотические фигуры). Митотический индекс является наиболее надежным способом прогнозировать биологическое поведение (митотический уровень <3 митозов/10 высокомощный полей обычно ассоциирован с доброкачественностью); однако ,10% гистологически доброкачественных меланоцитом ведут себя как злокачественная опухоль.
3 У животных с злокачественными меланомами должны быть исследованы региональные лимфоузлы и грудная и брюшная полость для выявления метастазов.
Лечение и прогноз
1 Лечением выбора является радикальное хирургическое иссечение, поскольку, доброкачественные мелоноцитомы не могут быть клинически дифференцированы от злокачественных меланом.
2 Если хирургическое иссечение неполное, то дополнительные варианты лечения включают лучевую терапию и локальную гипертермию.
3 Химиотерапия (карбоплатин, пироксикам и дакарбазин) могут увеличивать продолжительность жизни в некоторых случаях злокачественной опухоли, но, в целом, ответ на химиотерапию слабый.
4 Хотя она была оценена первично на оральной злокачественной меланоме собак, выпускаемая фирмой Мериал ксеногенная ДНК вакцина против меланомы может быть полезна для борьбы с системными метастазами при злокачественных меланоцитомах кожи.
5 Томотерапия, продвинутая форма радиационной терапии, использующая точность технологии компьютерного сканирования, может в будущем обеспечивать лучший исход, с сравнении с имеющимися в настоящее время методами лечения.
6 Прогноз хороший для доброкачественных меланоцитом. Прогноз плохой для злокачественных меланом, особенно, если опухоль большая, имеется рецидивирование после хирургической операции и метастазирование. Локализация опухоли прогностична: большинство оральных и слизистокожных меланом (за исключением опухолей век) и 50% меланом, вовлекающих когтевые ложа, являются злокачественными. Порода также прогностична: более чем 75% меланоцитарных опухолей у доберманов и у миниатюрных шнауцеров являются доброкачественными по поведению, и 85% этих опухолей у карликовых пуделей являются по поведению злокачественными.

Фото 1. Меланоцитома и меланома кожи собак и кошек. Пигментированный узелок вблизи носового зеркала у взрослой собаки.
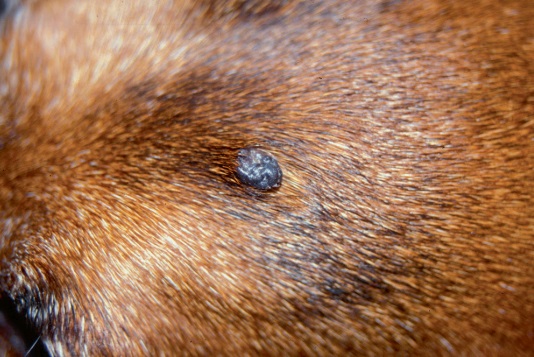
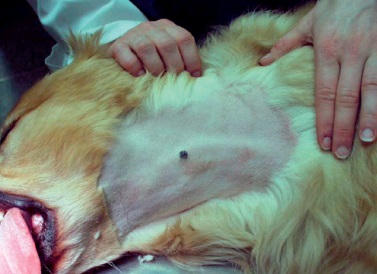
Фото 2. Меланоцитома и меланома кожи собак и кошек. Фокальный пигментированный узелок на голове у взрослой собаки.

Фото 3. Меланоцитома и меланома кожи собак и кошек. Многодольчатая безволосая гиперпигментированная меланома на голове у взрослого шнауцера.

Фото 4. Меланоцитома и меланома кожи собак и кошек. Фокальный пигментированный узелок.
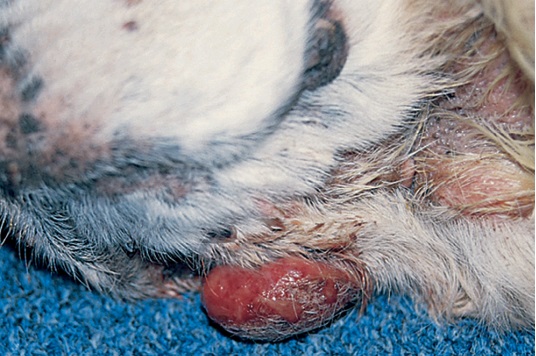
Фото 5. Меланоцитома и меланома кожи собак и кошек. Изьязвленная непигментированная меланома на вентральной части шеи у возрастного кокер спаниеля.
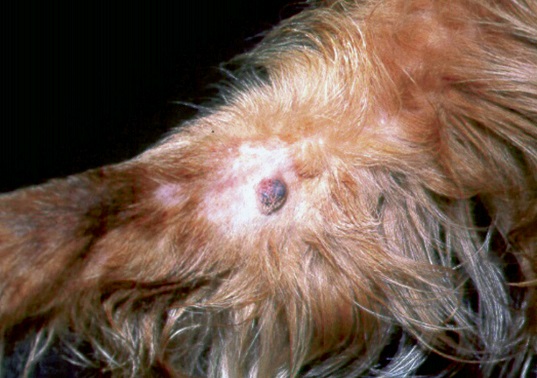
Фото 6. Меланоцитома и меланома кожи собак и кошек. Маленький пигментированный узелок на дистальной части лапы у взрослого золотистого ретривера.

Фото 7. Меланоцитома и меланома кожи собак и кошек. Меланома, вовлекающая твердое небо у собаки.
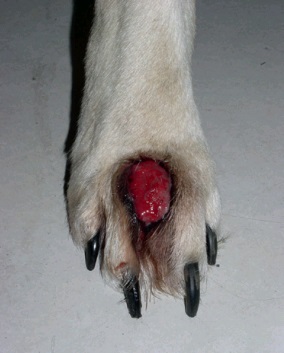
Фото 8. Меланоцитома и меланома кожи собак и кошек. Межпальцевая меланома у собаки со вторичным вовлечением кости.

Фото 9. Меланоцитома и меланома кожи собак и кошек. Меланома на вентральной части шеи у собаки.
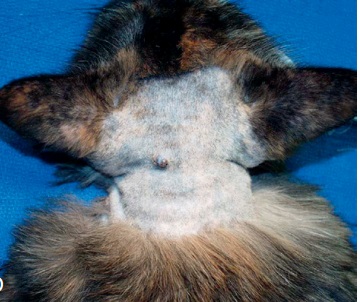
Фото 10. Меланоцитома и меланома кожи собак и кошек. Меланома на дорсальной части шеи у кошки.
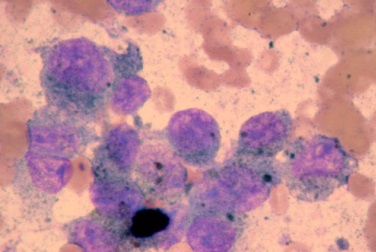
Фото 11. Меланоцитома и меланома кожи собак и кошек. Цитологическое исследование аспирата обнаружило несколько меланоцитов с критериями злокачественности.
Фото 7-11 из руководства Small Animal Dermatology Muller and Kirk’s 2013г
Источник
Новый класс персонализированных противораковых вакцин, адаптированных к опухолям отдельных пациентов, задержал развитие болезни в двух независимых клинических испытаниях.
Nature опубликовал одновременно два разных исследования от двух независимых команд, испытывавших персонализированные вакцины, лечащие или по крайней мере предохраняющие от рецидива меланомы на поздних, практически неизлечимых стадиях болезни.
Одна вакцина была разработана в американском Институте Dana Farber (Dana-Farber Institute), а другая — частной немецкой биотехнологической фирмой BioNTech, которая использует так называемый РНК-мессенджер, чтобы воспроизвести код для создания своих «терапевтических» белков.
Вакцина, разработанная в Dana Farber, работает с неоантигенами, специфичными для для опухоли конкретного человека.
Антигены — это молекулы, которые отображаются на поверхности клеток и стимулируют иммунную систему. Неоантигены являются молекулами на поверхностях клеток, которые продуцируются мутациями ДНК, которые присутствуют в раковых клетках, но отсутствуют в нормальных клетках. что делает неоантигены идеальными мишенями для иммунной терапии против рака, говорят ученыеВакцины, используемые в исследовании фазы I, содержали до 20 неоантигенов, полученных из опухоли конкретного пациента. Вакцины вводили пациентам для тренировки собственной иммунной системы для распознавания этих неоантигенов с целью стимулирования иммунной системы к уничтожению раковых клеток, на поверхности которых они находились.
Подход BioNTech заключается в работе с эпитопами, частями макромолекулы антигена, которые непосредственно являются мишенью для иммунных клеток.
В чем заключается уникальность новой вакцины?
Предыдущие методы иммунотерапии, такие как препараты ингибитора контрольной точки, также вызывают иммунные реакции против неоантигенов рака, но не имеют такой высокой специфичности. Они могут вызывать реакции иммунной системы организма против нормальных тканевых антигенов, приводя к тому, что иммунная система атакует нормальные ткани. Исследователи обнаружили, что персональная вакцина вызвала целенаправленный ответ Т-клеток на несколько неоантигенов опухолей, помимо того, что обычно наблюдается в ответ на существующие виды иммунотерапии.
Ученые из Dana-Farber Institute and Broad Institute вводили вакцину шести пациентам с меланомой, опухоли которых были удалены хирургическим путем, и которые были подвержены высокому риску рецидива. Вакцинация была начата через 18 недель после операции. При медиане 25 месяцев после вакцинации у четырех из шести пациентов не было обнаружено доказательств рецидива рака. У двух других пациентов, с метастазами в легкие, болезнь возобновилась после вакцинации. В этот момент они начали лечение препаратом пембролизумаб, который ингибирует иммунную контрольную точку PD-1. Оба пациента получили полное разрушение опухолей в результате курса лечения и увеличение количества специфических Т-клеток, готовых бороться с опухолями в случае рецидива. Вторая, неоэпитопная вакцина, тоже привела к вполне вдохновляющим результатам: иммунный ответ возник у всех пациентов, т-клетки убивали опухолевые клетки, ориентируясь на специфические маркеры-эпитопы. У двоих пациентов был достигнут эффект стабильной выживаемости без роста опухоли. Еще у двух пациентов с метастатической болезнью иммунный ответ был серьезный иммунный ответ, у одного, правда, наблюдался потом рецидив. Третий продемонстрировал полный иммунный ответ в сочетании с иммунотерапевтической блокадой PD1.
Результаты исследования показывают, что персонализированная неоантигенная вакцина может потенциально преодолеть два основных препятствия в терапии рака.
Одним из них является гетерогенность опухолей: тот факт, что они состоят из клеток с множеством различных признаков, часто позволяет злокачественным опухолям уклоняться от препаратов, нацеленных на злокачественные клетки, имеющие одну и ту же определенную генетическую аномалию. Вакцина, поскольку она содержит много разных неоантигенов из опухоли, нацелена на разные генетические аномалии опухолевых клеток. Этот метод демонстрируют большую перспективу в лечении рака, который обычно развивает устойчивость к моно-препаратам.
Второе препятствие при раке состоит в том, чтобы генерировать иммунный ответ, резко сфокусированный только на раковых клетках, избегая при этом атаки на нормальные клетки и ткани. Обе вакцины были запрограммированы атаковать только специфические антигены или их части — эпитопы, и поэтому имели очень скромные побочные эффекты.
Несмотря на десятилетия попыток разработать эффективные вакцины против рака, они в основном не смогли создать мощные противоопухолевые иммунные ответы. Авторы нового исследования говорят, что это было связано с тем, что все эти вакцины, как правило, были созданы на основе опухолевых антигенов, которые были слишком похожи на антигены нормальных клеток. В результате организм вырабатывал более слабый иммунный ответ, чтобы избежать атаки на нормальные клетки (процесс, называемый иммунной толерантностью). Поскольку новые вакцины изготавливают по «индивидуальному проекту» для каждого пациента, используя антигены, созданные мутациями, уникальными для рака именно этого конкретного пациента, и присутствуют только на раковых клетках, процесса иммунной толерантности удается избежать.
Что дальше?
Roche, крупнейший в мире производитель лекарств от рака, уже сделал ставку на технологию BioNTech после подписания в сентябре прошлого года контракта стоимостью 310 миллионов долларов, что позволит ему протестировать немецкую вакцину с помощью препарата для иммунотерапии Tecentriq.
Соучредитель и главный исполнительный директор BioNTech Угур Сахин(Ugur Sahin) сообщил, что комбинированные испытания с использованием препарата Roche против различных видов рака должны были начаться уже в конце этого года.
Конкурирующая биотехнологическая фирма Neon Therapeutics, которая была создана для проведения исследований в США, начала тестирование своей персонализированной вакцины из неоантигена в сочетании с препаратом Opdivo от Bristol-Myer’s в прошлом году.
Сколько стоит супер-вакцина?
Уже применяющиеся новые препараты, такие как Opdivo и Tecentriq, значительно усиливают иммунную систему организма и тем самым серьезно улучшают шансы на выживание больных с меланомой, но цена курса лечения составляет более 150 000 долларов в год. Сахин признал, что такая высокая стоимость вакцины сначала будет неизбежной, но, возможно, со временем ее цена может быть уменьшена за счет увеличения масштаба и автоматизации производства.
«В среднесрочной и долгосрочной перспективе стоимость вакцины должна заметно снизиться. Это индивидуальный метод лечения, но это универсальный процесс», — сказал он. «На данный момент мы находимся на очень ранней стадии, но в долгосрочной перспективе этот новый метод вакцинации может коренным образом изменить подход к лечению онкологических заболеваний».
Корнелиус Мелиеф (Cornelius Melief)из Медицинского центра Лейденского университета (Leiden University Medical Center), который не участвовал ни в одном из исследований, подтвердил, что исследование его немецких и американских коллег полностью доказало огромный потенциал неоантигенных вакцин.
«Контролируемые рандомизированные клинические испытания фазы II с большим количеством участников теперь необходимы для определения эффективности этих вакцин у пациентов с любым типом рака, который имеет достаточные мутации для обеспечения достаточных целей неоантигена для такого подхода», — сказал он.
Источник