Персистенция впч 16 что это такое
- ВПЧ – Вирус Папилломы Человека
HPV — Human PapillomaVirus
Папилломавирусы — это группа ДНК-содержащих вирусов, поражающих клетки эпителия органов и тканей: кожи, слизистых оболочек.
В чём опасность ВПЧ 16 типа для женщин?
Характерная особенность папилломавирусов — способность индуцировать образование различных эпителиальных опухолей.
Формы повреждения тканей, вызванных ВПЧ, многообразны. Встречаются бессимптомные и малозаметные: кератозы, дисплазии. Бывают клинически ярко выраженные: бородавки, папилломы, кондиломы. Большинство абсолютно безопасны. Без лечения они остаются пожизненным косметическим дефектом или исчезают самостоятельно (самоизлечение).
Но иногда доброкачественные поражения могут перерождаться в злокачественные опухоли – карциномы.
- Карцинома или эпителиальный рак – это злокачественная опухоль, которая развивается из изменённых клеток эпителия различных тканей.
На сегодняшний день установлено, что папилломавирусная инфекция – ведущая причина развития рака шейки матки. При клинически выраженном цервикальном раке ВПЧ высоких рисков онкогенности выявляется в 95-100% случаях.
Известно около 100 серотипов папилломавирусов. Около 17 считаются онкогенными.
- В группу наиболее высокого риска входят ВПЧ типов: 16, 18, 31, 33, 35, 39, 45, 46, 51, 52, 56, 58, 59 и 68.
- Вирусами низкого риска остаются ВПЧ типов: 6, 11, 42, 43, 44.
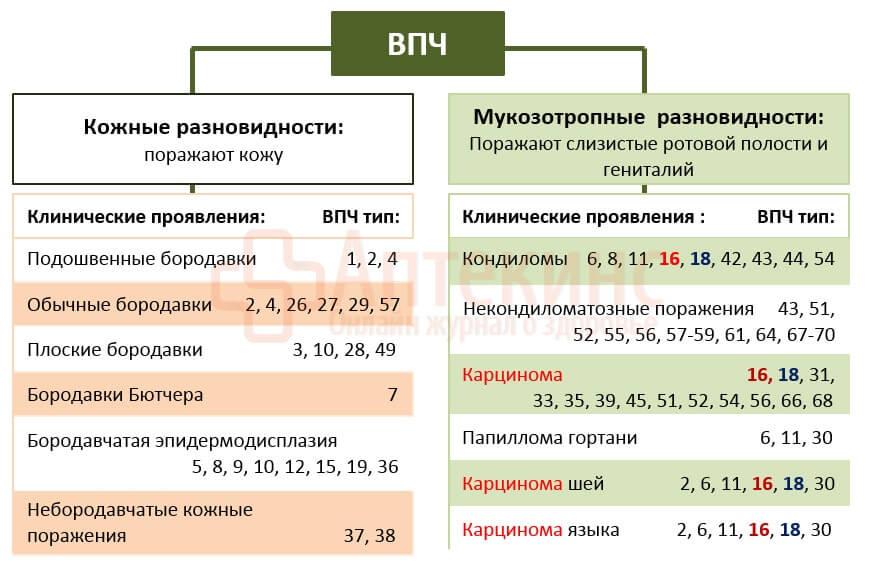
Для женщин особенно опасны ВПЧ 16 и 18 типов: они чаще всего вызывают рак шейки матки.

На ВПЧ 16/18 приходится 70% ассоциированного с папилломавирусной инфекцией цервикального рака. Причём наиболее распространённый плоскоклеточный рак связывают с ВПЧ 16 типа. А редко встречающийся железистый рак – с ВПЧ 18 типа.
Заражение ВПЧ 16 типа
Распространённость папилломавирусной инфекции чрезвычайно велика: ДНК тех или иных (иногда сразу нескольких) типов ВПЧ обнаруживаются более чем у 80% взрослого населения.
Мукозотропные ВПЧ, в том числе серотип 16, относят к инфекциям, передающимся половым путём (ИППП). Вероятность заражения через кровь, предметы быта, тем более воздушно-капельным путём ничтожна.
Пути заражения ВПЧ 16 типа:
- Половой путь: традиционный, оральный, нетрадиционный сексуальный контакт с инфицированным партнёром.
- Внутриутробно: заражение плода от инфицированной матери через плаценту или околоплодные воды.
- Во время родов: заражение новорожденного при прохождении по поражённым кондиломами родовым путям матери.
Что происходит после заражения ВПЧ 16 типа?
Подавляющее большинство инфицированных ВПЧ не подозревают о случившемся и в дальнейшем не имеют никаких осложнений.
Более того, до 75% сексуально активных женщин на протяжении жизни заражаются различными типами ВПЧ по нескольку раз. Однако у 2/3 женщин активная инфекция через некоторое время частично или полностью выводится из организма системой иммунитета.
«Остатки» вирусов «консервируются» в чувствительных тканях в виде ДНК ВПЧ и наследуются внутри заражённого клона клеток на протяжении всей жизни носителя. В момент ослабления местного или общего иммунитета скрытая ВПЧ-инфекция «просыпается», рецидивирует, проявляется клинически.
Причины снижения иммунитета к ВПЧ 16 типа у женщин:
— беременность;
— возрастные изменения, связанные со старением организма;
— острые, хронические гинекологические, соматические, воспалительные, инфекционные заболевания;
— ИППП: хламидиоз, генитальный герпес, ЦМВИ, трихомониаз, гонорея, сифилис, ВИЧ, др.
— гормональный дисбаланс;
— нейроэндокринные, метаболические нарушения, ожирение;
— операции, травмы, аборты, тяжёлые роды;
— хронический стресс, физическое истощение;
— лечение цитотоксическими, иммуносупрессивными препаратами;
— агрессивная инсоляция, ионизирующее облучение, лучевая терапия;
— курение, алкоголизм.
Длительное малопродуктивное персистентное течение ВПЧ-инфекции возможно только на фоне дефектов иммунитета.
Симптомы ВПЧ 16 типа у женщин
- Латентная инфекция – симптомов нет.
Присутствие вируса можно выявить лишь с помощью современных иммунохимических или молекулярно-биологических методик, которые определяют наличие в организме антигенов или ДНК ВПЧ.
У женщин даже бессимптомное течение ВПЧ 16 типа может инициировать рак шейки матки.
- Субклиническая
ВПЧ-инфекция персистирует (то обостряется, то стихает), протекает малозаметно, на фоне хронического вульвогинита, эндоцервицита, псевдоэрозии шейки матки. Иногда пациентку беспокоят жжение, зуд в генитальной области. Возможны скудные аномальные выделения из влагалища, дизурические явления.
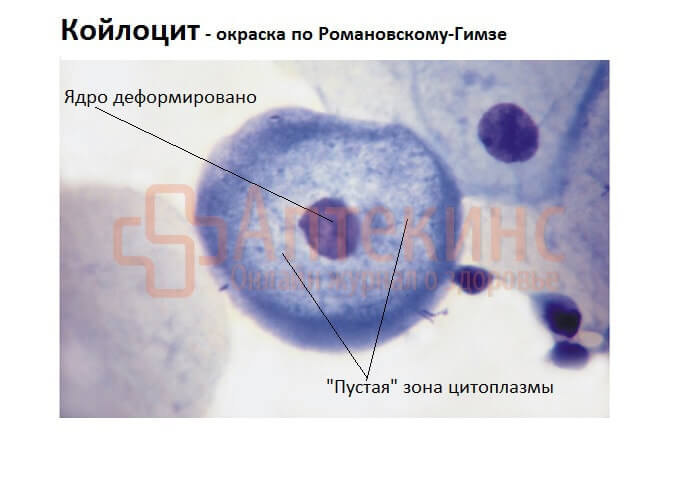
В цервикальных мазках появляются: койлоциты, лейкоциты, атипичные клетки; иногда — патогенная флора (сочетание ВПЧ-инфекции с другими ИППП вполне закономерно).
Каким должен быть мазок из влагалища у здоровой женщины подробно читайте в статье: Повышенные лейкоциты в мазке у женщины – причины.
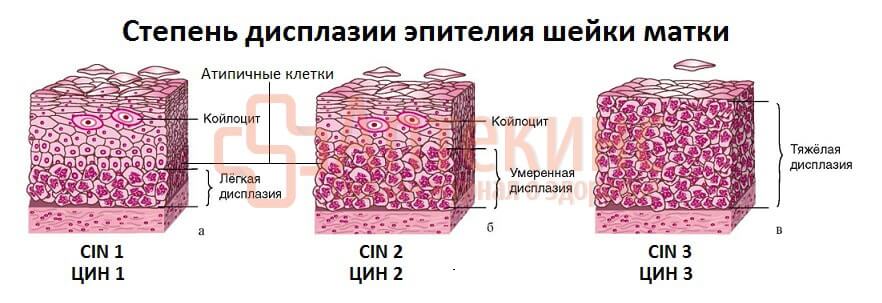
В гистологических препаратах цервикальной слизистой видны патологические изменения структуры эпителия шейки матки. При опухолевой трансформации появляется дисплазия (неоплазия, ЦИН).
- Клинически выраженная
ВПЧ-инфекция у женщин – это папилломатоз или кондиломатоз вульвы, влагалища, шейки матки, аногенитальной области.
Как вылечить кондиломы, как выглядят аногенитальные бородавки — читайте подробно в статье: Кондиломы остроконечные.
ВПЧ 16 типа и рак шейки матки

В состав папилломавирусов высокого риска входят специфические структурные белки-онкопротеины Е6 и Е9. Они способны инактивировать внутриклеточный иммунитет. Их особенно много в ВПЧ 16 типа. Вызывая генетическую нестабильность, онкопротеины ВПЧ 16 инициируют мутацию клеток, развитие интраэпителиальной неоплазии, рака шейки матки.
Дисплазия шейки матки или цервикальная интраэпителиальная неоплазия (ЦИН/CIN) – это нарушение структуры эпителиальных пластов цервикальной слизистой. Патологический процесс обусловлен аномальным размножением (пролиферацией) атипичных, трансформированных ВПЧ, клеток.
Цервикальная дисплазия – раннее проявление папилломавирусной инфекции, вызванной ВПЧ 16 и 18 типов.
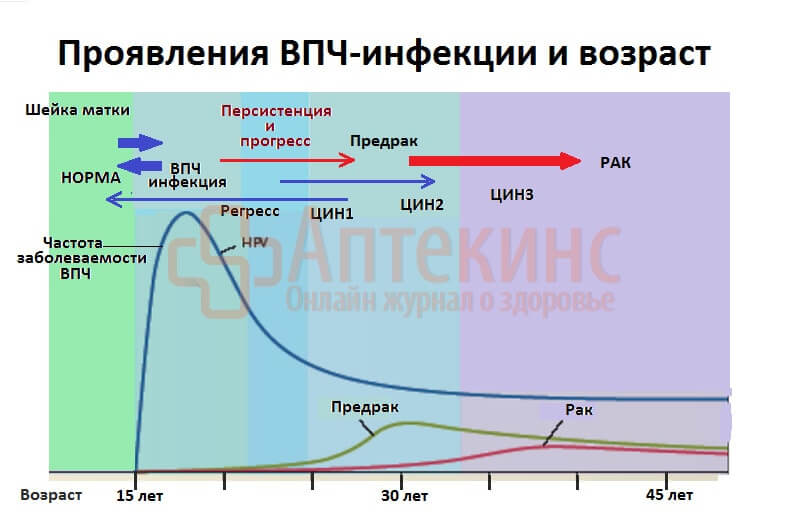
Умеренная и тяжёлая дисплазия (ЦИН 2-3) – предраковое состояние. Без лечения к 40-49 годам на фоне возрастных изменений иммунитета она может малигнизироваться в клинически выраженный (инвазивный) рак. Злокачественное перерождение прогрессирует очень медленно, годами.
Своевременное выявление и адекватное лечение ЦИН полностью предотвращает развитие рака шейки матки.
Вот почему каждая женщина, ведущая половую жизнь, должна делать плановую скрининг-диагностику ВПЧ и сдавать мазок на онкоцитологию (ПАП-тест).
ДНК-диагностика ВПЧ 16 типа у женщин
Материалом для данного исследования служат: влагалищный мазок или цервикальный соскоб.
Есть два основных молекулярных метода выявления и верификации серотипов ВПЧ:
1. ПЦР — метод полимеразной цепной реакции.
Позволяет найти в исследуемом материале ДНК определённого типа ВПЧ. ПЦР-тест высокочувствителен. Он выявляет даже минимальное количество вирусного генетического материала.
Но!
По его результатам сложно отличить активный инфекционный процесс от безопасного латентного ВПЧ-носительства.
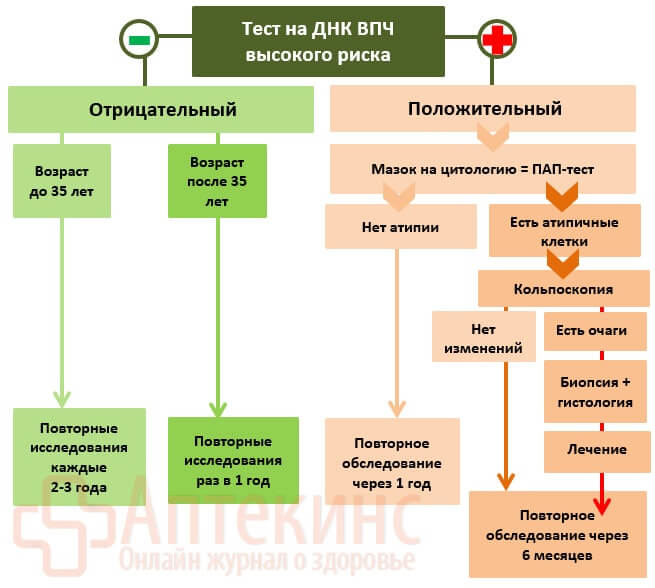
Расшифровка результатов ПЦР-теста на онкогенные ВПЧ 16/18 типов
| HPV 16/18, ДНК ПЦР-тест | Что значит? |
| Отрицательный | В биоматериале не найдено ДНК ВПЧ 16/18 типа: онкогенная ВПЧ-инфекция маловероятна. Повторный скрининг-тест через 2-3 года. |
| Положительный | В биоматериале обнаружены ДНК ВПЧ 16/18 типа. Рекомендовано: ПАП-тест + консультация специалиста. |
2. Метод гибридного захвата или ВПЧ Digene-Тест (НС2)
система двойной генной ловушки.
Преимущество Дайджен-теста перед ПЦР —
количественное определение клинически значимого уровня вирусной нагрузки.
Для выявления концентрации единственных серотипов ВПЧ 16/18 иногда используются ВПЧ-скрининг-тесты АмплиСенс ВПЧ 16/18-FL.
Клинически значимый (референсный) уровень вирусной нагрузки
| ВПЧ-тест | Пороговый уровень ДНК ВПЧ |
| Digene HPV-test | 1 pg/ml (или 105 копий ДНК ВПЧ в 1 мл) |
| ВПЧ тесты АмплиСенс | 3 lg на 105 клеточных геномов |
Расшифровка:
- «ДНК не обнаружено»
или
«-» результат отрицательный (концентрация ДНК ВПЧ меньше пороговой).
В биоматериале не найдено ДНК вируса или вирусная нагрузка клинически незначима.
Рекомендации: профилактическое посещение гинеколога 1 раз в год. Повторить ДНК ВПЧ-тест через 2-3 года.
- Результат «+» положительный:
Вирусная нагрузка превышает допустимый уровень.
Рекомендации: ПАП-тест, консультация специалиста, и, в случае необходимости, дальнейшее обследование.
Цитологическая диагностика ВПЧ 16 типа у женщин
Мазок на цитологию шейки матки = ПАП-тест.
Это исследование окрашенных мазков-отпечатков соскоба поверхности шейки матки под микроскопом.
Расшифровка:
- NILM — морфологически изменённых, атипичных клеток в мазке нет. Это значит, что ВПЧ-инфекции нет или она существует в безопасной латентной форме.
- КА, ASC, SIL — в мазке видны клетки шеечного эпителия, поражённые ВПЧ: койлоциты, дискератоциты (клетки плоского эпителия маленького размера с ороговевшей цитоплазмой), атипичные клетки, что указывает на субклиническое или клиническое течение ВПЧ.

По числу изменённых клеток в мазке, по выраженности атипии (многоядерность, деформация ядра, дистрофия цитоплазмы, др.) можно предположить степень цервикальной дисплазии: ЦИН1 – лёгкая, ЦИН2 – умеренная, ЦИН3 – тяжёлая, СIS – преинвазивная карцинома.
Подробно о ПАП-тесте: как берётся мазок на цитологию, жидкостная цитология, расшифровка цитологии — читайте в статье: Цитология шейки матки – что это такое, расшифровка, атипичные клетки.
Эндоскопическая диагностика ВПЧ 16 типа у женщин
Расширенная кольпоскопия — осмотр оболочек влагалища и шейки матки с помощью оптического прибора кольпоскопа после их обработки химическими веществами (проба с уксусной или салициловой кислотой, проба с раствором Люголя).
При визуализации участков изменённого эпителия пациентка направляется на прицельную биопсию шейки матки. Окончательный диагноз и тактику лечения устанавливают на основании гистологического исследования образца патологической ткани (биоптата).
Если у женщины обнаружено ВПЧ 16 типа – что делать?
Установлено, что присутствие сверхпороговых уровней ДНК ВПЧ у женщин в 99% сопровождается дисплазией эпителия шейки матки (ЦИН) разной степени выраженности.
Порядок действий при ВПЧ-тесте «+» (положительном):
Как лечить ВПЧ 16 у женщин
Медикаментозных, иных средств, для выведения из организма или полного уничтожения ВПЧ 16 не существует .
Поэтому лечение ВПЧ 16/18/… направлено не на искоренение вируса, а на разрушение и удаление поражённых им тканей, на восстановление, укрепление общего и местного иммунитета.
Другими словами, у женщин лечат не ВПЧ 16, а его клинические проявления, болезненные последствия: кондиломы, дисплазию ЦИН, рак шейки матки. Одновременно выявляют и по мере возможности устраняют причины ослабления или дефекта иммунитета.
Местное лечение кондиломатоза:
Физическая или химическая деструкция (разрушение) поражённой ткани:
— криодеструкция;
— лазерное лечение;
— диатермокоагуляция;
— электрохирургическое иссечение;
— Химические методы: солкодерм, трихлоруксусная кислота, подофиллотоксин (требуется консультация врача, есть противопоказания).
Иммунологические методы лечения ВПЧ 16/18/…:
Неспецифическая противовирусная терапия:
— препараты интерферонов а-, β-, γ-;
— препараты-индукторы эндогенного интерферона.
Режим и форму приёма интерферонов назначает врач.
Есть противопоказания и тяжёлые побочные эффекты.
Лечение дисплазии шейки матки (ЦИН):
ЦИН1 – динамическое наблюдение с повторным обследованием каждые 6 мес. Выявление и лечение сопутствующей ИППП. Если дисплазия не регрессирует, проводят криодеструкцию, лазерное лечение или хирургическое иссечение (конизацию) патологической ткани шейки матки.
ЦИН2/3 – лазерное лечение, конизация или ампутация шейки матки.
Сочетание любого варианта ЦИН с миомой, эндометриозом матки — радикальное удаление матки (экстирпация).
Возможно ли самоизлечение от симптомов ВПЧ 16 типа у женщин?
Да. В 50% случаев пороговая вирусная нагрузка, единичные кондиломы, незначительная атипия (КА, ASC-US), лёгкая дисплазия (ЦИН 1) регрессируют и разрешаются без лечения.
Пациенткам с пороговой патологией рекомендуется активное наблюдение, повторное обследование через 3 или 6 месяцев. Важна оптимизация образа жизни: отказ от курения, алкоголя, борьба с лишним весом. При необходимости назначается консультация иммунолога, лечение сопутствующих гинекологических, нейроэндокринных, соматических болезней.
Профилактика ВПЧ 16 типа у женщин
Презерватив не защищает женщину от заражения ВПЧ 16 типа в полной мере.
- Вакцинация (смотрите видео).
- Разумный выбор полового партнёра. Барьерная контрацепция (презерватив) снижает риск заражения ВПЧ.
- Ежегодное диспансерное гинекологическое обследование.
Вероятность заболеть раком шейки матки при «+» тесте на ВПЧ 16 типа
Отметим, что многозначный вопрос происхождения цервикального рака до сих пор не нашёл окончательного решения. Папилломавирусная инфекция – обязательное, но не единственное условие его развития.
Другими словами: все женщины, заболевшие раком шейки матки, были инфицированы ВПЧ высокого риска. Но очень немногие, инфицированные ВПЧ 16/18/… женщины, обязательно заболевают этим раком.
Совокупные риски развития рака шейки матки:
1. Генетическая предрасположенность.
Врождённо высокая чувствительность организма к папилломавирусам. Врождённо-низкий специфичный к ВПЧ противовирусный иммунитет.
2. Заражение инфекцией высокого риска: ВПЧ 16/18/… типов.
3. Вторичный иммунодефицит. Приобретённые дефекты иммунитета, снижение местной или общей резистентности организма.
4. Фоновые заболевания матки: полипы, гиперплазия эндометрия, миома, эндометриоз, кольпиты, цервициты.
5. Травмы шейки матки во время аборта, родов, приводящие к нарушению иннервации и питания цервикальных тканей.
6. Курение.
7. Длительный, неадекватный приём гормональных контрацептивов (КОК).
Нажмите «ЗВЕЗДОЧКУ» сверху 🙂
Источник
Авторами было проведено плацебоконтролируемое исследование, в ходе которого была проанализирована эффективность терапии аллофероном у пациенток с персистирующей папилломавирусной инфекцией. Были выявлены выраженные нарушения локальных иммунных реакций, обусловленных дисбалансом продукции цитокинов при поражении вирусом папилломы человека (ВПЧ) шейки матки. На фоне терапии аллофероном улучшались вирусологические, кольпоскопические и цитологические показатели, препарат хорошо переносился. Это позволяет рекомендовать аллоферон в качестве противовирусного и иммуномодулирующего средства в составе комплексной терапии для лечения инфекции, вызванной онкогенными типами ВПЧ, и для монотерапии выявленных онкогенных типов ВПЧ при отсутствии каких-либо аномальных изменений шейки матки или генитальных кондилом.
Введение
Рост инфицированности вирусом папилломы человека (ВПЧ) обусловливает актуальность проблемы ВПЧ-ассоциированных заболеваний гениталий [1, 2]. ВОЗ (1996), а также Европейская ассоциация по генитальным инфекциям и неоплазиям (European Research Organization on Genital Infection and Neoplasia, EUROGIN) (2003) подтвердили, что причиной возникновения рака шейки матки являются высокоонкогенные типы вируса папилломы человека. Папилломавирусная инфекция гениталий отличается высокой контагиозностью. По данным многочисленных эпидемиологических исследований, ДНК ВПЧ определяется у 3–10% здоровых женщин, а также в 50–80% случаев при различных клинических формах остроконечных кондилом, в 12–30% – при доброкачественных поражениях шейки матки, от 19 до 90% – при цервикальных интраэпителиальных неоплазиях, в 58–95% случаев – при внутриэпителиальных карциномах [3–5].
В зависимости от проявлений папилломавирусной инфекции на гениталиях выделяют следующие ее формы:
- клиническую (экзофитные кондиломы различной локализации: вульва, влагалище, промежность, половые губы, перианальная область у женщин, половой член у мужчин);
- субклиническую (изменения, выявляемые только при кольпоскопии, цитологическом и гистологическом исследованиях: кондиломатозный цервицит и вагинит, плоские кондиломы шейки матки, различные изменения многослойного плоского эпителия, инвертированные кондиломы с локализацией в криптах);
- латентную (обнаружение ДНК вируса при отсутствии клинических и морфологических проявлений).
Клинические и субклинические формы ВПЧ обнаруживают также у 40–60% мужчин – половых партнеров инфицированных женщин [6]. Кроме того, папилломавирусная инфекция является фактором риска развития цервикальной интраэпителиальной неоплазии (дисплазии слабой, умеренной или тяжелой степени) и инвазивной карциномы (плоскоклеточной или железистой) [7].
ВПЧ отличается высокой тропностью к пролиферирующим клеточным популяциям, инфицирует эпителиальные клетки базального слоя эпителия. Инвазия вируса происходит через микроповреждения тканей (механические, бактериальные и др.), когда глубина их достигает базального слоя эпителия. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя и переходных типов эпителия, где пролиферирующие клетки находятся близко к поверхности. Этим фактом, возможно, объясняется частота инфицирования шейки матки и нижней трети влагалища и вульвы [8].
ВПЧ не всегда манифестирует, возможно бессимптомное течение, транзиторный и персистирующий характер инфекции. Персистирующее носительство впоследствии приводит к дисплазии, которая в свою очередь может трансформироваться в рак шейки матки. При включении вирусной ДНК в ядерный материал клетки хозяина возникает интегрированная форма ВПЧ. В этой форме вирусные частицы не реплицируются, а вирусная ДНК начинает контролировать клеточный генетический материал для синтеза ВПЧ-кодированных белков. Диспластические процессы шейки матки ассоциированы с началом продукции двух ранних онкопротеинов Е6 и Е7, взаимодействующих с эндогенными клеточными регуляторными белками и нарушающих цикл клеточной прогрессии. В неинтегрированной форме продуцируются неповрежденные вирусные частицы. Отличительной особенностью продуктивной инфекции является формирование остроконечных кондилом, имеющих низкую вероятность развития неопластических процессов в эпителии и эпидермисе. Диссеминация вируса чаще происходит на фоне дисбаланса иммунной системы, причем локальные проявления инфекции регистрируются максимально быстро с момента инфицирования и инвазии вируса в ткани. В процессе патогенного воздействия вируса содержимое клетки «выбрасывается» в межклеточное пространство вместе с вирусными частицами, которые попадают в макрофаги, проникают в дерму, сосуды капиллярного сплетения, образуя резервуар папилломавирусной инфекции [6, 9].
В предотвращении клинической манифестации папилломавирусной инфекции важную роль играет иммунный ответ. ВПЧ эпителиотропен, поэтому особое значение имеет состояние факторов местной защиты слизистой гениталий.
Ткани шейки матки обладают автономной иммунной системой, представленной местным клеточным и гуморальным иммунитетом. Они отграничивают внутреннюю среду (стерильную полость матки) от «агрессивной» внешней среды (влагалища).
Местная противоинфекционная защита обеспечивается комплексом лимфоидных структур, фагоцитирующих клеток, в том числе макрофагов стромальных тканей шейки матки, секреторных гуморальных и цитокиновых факторов. Цервикальные эпителиальные клетки, предположительно, являются основой для развития иммунного ответа на слизистой. В исследованиях in vivo и in vitro показано, что клетки цервикального эпителия секретируют цитокины, экспрессируют на своей поверхности Toll-like-рецепторы и осуществляют разграничение верхнего и базального слоев [10, 11]. Исследования клеточных линий показали различную иммунореактивность клеток цилиндрического и плоского эпителия [12]. Клетки цервико-вагинальной зоны не только продуцируют цитокины/хемокины, но и являются мишенью для воздействия цитокинов, вырабатываемых другими клетками. В противовирусной защите при ВПЧ-инфекции наиболее существенную роль играют клетки, которые находятся в прямом контакте с вирусом [9, 13]. Многочисленные исследования указывают на наличие тесной взаимосвязи между уровнем продукции цитокинов и клиническими характеристиками инфекционного процесса, но при этом отсутствует единое мнение о патогенетическом значении отдельных регуляторных пептидов на разных стадиях болезни [14, 15].
Несмотря на многочисленные исследования местного иммунитета в защите от ВПЧ, механизмы действия клеточных и цитокиновых компонентов иммунитета слизистых в отношении персистенции вируса изучены недостаточно. Персистенция ВПЧ высокого риска является ключевым событием в малигнизации клеток, что обусловливает необходимость изучения факторов, инициирующих этот процесс и, следовательно, способствующих реализации онкогенного потенциала ВПЧ.
Аллоферон в терапии ВПЧ-инфекции
Современный подход к терапии ВПЧ-инфекции основан на данных об особенностях взаимодействия вируса папилломы с организмом хозяина, зависит от формы ВПЧ-инфекции, возраста пациента, длительности персистенции вируса и предполагает местное (деструкция или эксцизия пораженных тканей) или системное лечение (противовирусные препараты и иммунотерапия), а чаще всего – комбинированную терапию [9, 16].
Несмотря на достаточный арсенал противовирусных препаратов, лечение папилломавирусной инфекции остается весьма сложной задачей. Аллокин-альфа – первый представитель новой группы антивирусных препаратов природного происхождения на основе действующего вещества аллоферон. Первоначально это семейство биологически активных пептидов было выделено из клеток иммунной системы «хирургических личинок» – насекомых семейства Calliphoridae.
Аллокин-альфа – противовирусный препарат нового поколения, относится к группе препаратов, «запрещающих выключение цитокинов». Аллокин-альфа обладает иммунотропным эффектом за счет усиления продукции интерферона (ИФН) гамма естественными киллерными клетками в ответ на стимуляцию интерлейкина (ИЛ) 12. Ранний механизм действия Аллокина-альфа включает индукцию синтеза ИФН-альфа в очаге вирусной инфекции. Препарат стимулирует лейкоциты, усиливая их способность к продукции противовирусного ИФН в ответ на инфекцию. Терапевтическое действие аллоферона направлено на усиление распознавания вирусных антигенов иммунокомпетентными клетками и уничтожение очагов вирусной инфекции.
Материалы и методы
С целью поиска новых подходов к лечению папилломавирусной инфекции проведена оценка факторов цитокинового ответа при персистирующем течении инфекции и проанализировано влияние терапии Аллокином-альфа на показатели иммунитета у пациенток с ВПЧ.
Для решения поставленных задач было проведено обследование женщин с наличием ВПЧ высокого риска в цервикальном канале, обратившихся на амбулаторно-поликлинический прием в поликлинику ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Критериями включения пациенток в данное исследование являлись:
- наличие репликации ВПЧ онкогенного типа (16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 26, 51, 53, 56, 66, 68, 82-го) на слизистой цервикального канала, установленное методом полимеразной цепной реакции;
- хроническая ВПЧ-инфекция в течение 2 и более лет с момента установленного инфицирования.
В исследование не включались беременные и кормящие женщины; женщины детородного возраста, не получающие адекватной контрацепции; женщины, имеющие цитологически значимые отклонения, дисплазию шейки матки тяжелой степени, рак in situ. Критерием исключения также было наличие сопутствующих урогенитальных инфекций в активной фазе, требующих проведения соответствующей терапии, и острых состояний, способных существенно повлиять на результаты исследования.
Всего углубленное обследование с включением молекулярно-генетических, кольпоскопического, цитологического методов было проведено 60 пациенткам. 40 женщин составили основную группу, им была назначен препарат Аллокин-альфа, 20 женщин соответствующего возраста и с аналогичным диагнозом вошли в контрольную группу и получали плацебо.
Диагностика папилломавирусной инфекции у женщин основывалась на молекулярно-биологическом методе идентификации ВПЧ в клетках цилиндрического и многослойного плоского эпителия шейки матки. Проводилось типирование и определение клинически значимой концентрации 18 ДНК-типов вируса папилломы человека (16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 26, 51, 53, 56, 66, 68, 82, 44-го (55-го)). В основной группе чаще всего выявлялись высокоонкогенные типы ВПЧ – 16-й или 18-й (77,5% пациенток, n = 31). Другие исследуемые типы ВПЧ (чаще всего 31, 35, 39, 56, 58, 68-й) определялись у 22,5% (n = 9) пациенток.
Моноинфекция в основной группе была установлена у 30% (n = 12) пациенток, как правило, это был ВПЧ 16-го типа. Ассоциация двух и более типов ВПЧ зафиксирована в 70% случаев, при этом одним из возбудителей являлись высокоонкогенные 16-й или 18-й типы ВПЧ, в том числе у 1 (2,5%) пациентки отмечена ассоциация 7 типов ВПЧ (16, 31, 33, 52, 58, 68, 82-го). Ассоциация нескольких высокоонкогенных типов ВПЧ, особенно 16-го и 18-го, на фоне патологии шейки матки является неблагоприятным прогностическим признаком развития дисплазии шейки матки и трансформации ее в рак. В то же время, по данным исследований, кроме онкогенности типа вируса, пусковыми звеньями трансформации могут служить дефекты или поломки на уровне функционирования эпителиального матрикса и противовирусного иммунного ответа [17].
В ходе исследования оценивались биообразцы соскоба с шейки матки методом ПЦР с детекцией в режиме реального времени для определения вирусной нагрузки (количество копий генетического материала вирусного патогена в анализируемом объеме). Клиническая значимость количественного определения ВПЧ основана на ряде работ, указывающих на то, что вирусная нагрузка ниже определенного значения («порог значимости») не встречается в образцах тяжелой дисплазии и рака и ассоциирована с регрессией инфекции (клинически незначимое инфицирование) [5]. У пациенток основной группы 14 типов ВПЧ (16, 18, 31, 35, 39, 45, 52, 58, 51, 53, 56, 66, 68, 82-й) имели исходно клинически значимую концентрацию вируса (в среднем от 3,6 ± 0,3 до 6,8 ± 0,1 lg, копий/обр.).
Проведение осмотра шейки матки при помощи зеркал и расширенной кольпоскопии позволило выявить аномальные кольпоскопические картины (мозаика, пунктуация, ацетобелый эпителий, атипичные сосуды), эктопию и другие образования (кондиломы, лейкоплакия, кисты) шейки матки. У 92,5% (n = 37) женщин основной группы выявлялась аномальная кольпоскопическая картина шейки матки. В результате проведенного цитологического исследования у 37,5% (n = 15) женщин выявлены неопределенные полиморфные изменения мазка, что соответствовало 2-му классу мазка по системе Папаниколау. У 47,5% (n = 19) пациенток изменений в цитологическом составе мазка не обнаружено. У 10% (n = 4) женщин изменения морфологии клеточных элементов были обусловлены воспалением, кроме того, у 15% (n = 6) пациенток отмечена легкая степень дисплазии.
Исследование цитокинового профиля проводилось в сыворотке крови и цервико-вагинальной слизи с помощью иммуноферментного анализа («Вектор-Бест», Новосибирск; ООО «Цитокин», Санкт-Петербург). Забор биообразцов из цервико-вагинальной зоны проводили ложкой Фолькмана (в разведении 1:1 на 1,0 мл физиологического раствора). Исследованы уровни следующих провоспалительных и иммунорегуляторных цитокинов: ИФН-альфа, ИФН-гамма, ИЛ-6, ИЛ-10, фактор некроза опухоли (ФНО) альфа, ИЛ-18.
Проведен анализ сывороточного и локального цитокинового профиля при папилломавирусной инфекции с целью выяснения возможных маркеров тяжести и распространенности воспалительного процесса от уровня цитокинов. Однако отличий цитокинового ответа в сыворотке крови от нормальных показателей выявлено не было (р > 0,05), за исключением тенденции к увеличению ИЛ-18. Исследование цитокинов в цервикальном секрете при хроническом персистирующем течении ВПЧ-инфекции характеризовалось уменьшением или отсутствием изменений содержания ИФН-альфа, ФНО-альфа и увеличением уровня ИФН-гамма, ИЛ-6, ИЛ-10, ИЛ-18. Полученные результаты свидетельствуют о нарушении работы клеточных механизмов, что приводит к длительной персистенции ВПЧ-инфекции. Оценивая содержание ИФН-гамма в цервикальной слизи у женщин с патологией шейки матки, ассоциированной с ВПЧ, по сравнению со здоровыми женщинами установлено достоверное (р
Уровень другого провоспалительного цитокина – ФНО-альфа – в цервикальном секрете составил 0,90 ± 0,04 пг/мл и не отличался от показателя нормы (0,99 ± 0,05 пг/мл). Обращал на себя внимание широкий диапазон колебаний ИЛ-6 и ИЛ-10 в цервикальном секрете, при этом распределение значений переменных в сыворотке и местно было асимметричным. У 32,5% пациенток уровень ИЛ-6 в секрете шейки матки был выше, чем в сыворотке крови, в 20% случаев имелось достоверное повышение содержания ИЛ-10 в крови по сравнению с цервикальным секретом. Биологическое значение ИЛ-6 в первую очередь заключается в индукции восстановительных механизмов и активации иммунных реакций. Возможно, ИЛ-6 выполняет также роль регулятора развития иммунитета, переводя воспаление из острой фазы в хроническую, влияя на процессы апоптоза лейкоцитов, эпителиальных клеток [15, 18]. Повышение уровня ИФН-альфа не было отмечено как в локальном цитокиновом ответе, так и в сыворотке крови.
Полученные нами результаты демонстрируют выраженные нарушения локальных иммунных реакций, обусловленных дисбалансом продукции цитокинов при поражении вирусом папилломы человека шейки матки, что впоследствии может инициировать развитие дисплазии шейки матки.
После проведенного комплексного обследования пациентки основной группы получали лечение препаратом Аллокин-альфа по схеме 1 мг п/к через 48 часов, курс – 6 инъекций. Для оценки эффективности проведенной терапии всем пациенткам через 1 и 3 месяца после завершения лечения проведено комплексное обследование с вирусологическими, цитологическими, кольпоскопическими параметрами. Пациентки контрольной группы, которые получали плацебо, также были обследованы.
Результаты и их обсуждение
После проведения терапии Аллокином-альфа у 20% пациенток получено полное подавление репликации онкогенных типов ВПЧ (16, 18, 44, 39, 68-го). В 50% случаев выявлено снижение титра ВПЧ до значений ниже клинически значимого порога 3 lg, копий/обр. (33, 45, 51, 56, 59, 68, 44-й (55-й) типы) и числа обнаруженных типов ВПЧ (18, 31, 35, 39, 53, 66-й). Отмечено достоверное снижение уровня кольпоскопического индекса. Улучшение кольпоскопической картины наблюдалось у 47,5% женщин. Наличие высокоатипических кольпоскопических признаков в основной группе после терапии уменьшилось в 3 раза. В целом у 92,5% пациенток на 3-м месяце наблюдения обнаруживались только низкоатипические признаки (p
При исследовании эффективности терапии патологии шейки матки, вызванной вирусами ВПЧ онкогенного типа, нами изучено содержание провоспалительных цитокинов – ИЛ-18, ФНО-альфа, ИФН-альфа и гамма – исходно, на 1-м и 3-м месяце наблюдения. Исходно у пациенток с ВПЧ фиксировались высокие уровни ИЛ-18 и ИФН-гамма. Исследование в динамике не выявило изменений в уровнях сывороточных ИФН альфа и гамма. Колебания уровня ФНО-альфа также были незначительными, не превышая границы нормальных значений у пациенток обеих групп.
Нами изучено содержание ИЛ-18 у пациенток основной группы после терапии в зависимости от эффективности элиминации ВПЧ. В результате у 20% пациенток с очень хорошим эффектом (отсутствие ВПЧ в мазке после лечения) наблюдалось повышение уровня ИЛ-18 в среднем с 114,83 ± 5,7 до 130,50 ± 6,5 пг/мл на 1-м месяце наблюдения и тенденция к снижению на 3-м месяце до 99,00 ± 4,8 пг/мл, р
В исследованиях in vitro показано, что УФ-индуцированная продукция провоспалительных цитокинов ИЛ-альфа/бета, ИЛ-6, ИЛ-8 и ИЛ-18 в кератиноцитах человека подавляется под действием аллоферона. Возможно, снижение уровня провоспалительного ИЛ-18 к 3-му месяцу после лечения у пациенток с хорошим эффектом ассоциировано со снижением воспалительного процесса в области шейки матки и подавлением репликации ВПЧ. Однако, с учетом активирующего влияния ИЛ-18 на синтез ИФН-гамма и противовирусный иммунный ответ, повышение его уровня на 1-м месяце после воздействия Аллокина-альфа также может являться положительным моментом терапии.
Заключение
Таким образом, хорошая переносимость препарата и улучшение вирусологических, кольпоскопических и цитологических показателей позволяют рекомендовать включение Аллокина-альфа как противовирусного и иммуномодулирующего средства в состав комплексной терапии инфекции, вызванной онкогенными типами ВПЧ, и для монотерапии выявленных онкогенных типов ВПЧ при отсутствии каких-либо аномальных изменений шейки матки или генитальных кондилом. Дальнейшие исследования роли цитокинов в регуляции иммунного ответа, направленного против инфекционных деструктивных и неопластических процессов, предоставляют возможность расширить представления о патогенетическом значении иммунных нарушений и разработать иммунокоррекцию, что позволит оптимизировать терапию ВПЧ.
Источник

