Пцр впч вкр генотипирование качественное определение 16 генотип

Диагностирование ВПЧ осложняется вялым развитием процессов в молодом организме, которые часто не дают специфической симптоматики. Для выявления болезни на ранней стадии и профилактического контроля заболеваемости используют централизованный скрининг на ВПЧ ВКР.
Что такое скрининг ВПЧ ВКР
Скрининг – это целенаправленное обследование определенных групп населения с целью выявить заболевание. Скрининг проводится по специально разработанной методике подготовленным персоналом.
ВПЧ представляет собой заразные штаммы ДНК содержащего папилломавируса.
Все папилломавирусы (а их насчитывается больше сотни) делят на:
- высокоонкогенные штаммы – вирусы, которые способны вызвать дисплазию тканей кожи или слизистых человека, с последующим их злокачественным перерождением;
- низкоонкогенные – группа вирусов, деятельность которых вызывает доброкачественные образования (папилломы, бородавки).
Обратите внимание! Аббревиатура ВКР означает высокий канцерогенный риск. ВПЧ ВКР – так обозначают штаммы вируса, которые вызывают рак. У женщин это рак шейки матки, у мужчин – рак полового члена. Для Европейских жителей и населения России это 18, 16, 31 и 45 генотипы папилломавируса.
При активизации ВПЧ типа ВКР происходит изменение и перерождение тканей, которое оканчивается злокачественным процессом.
Скрининг на папилломавирусы высокой степени онкогенности проводят пошагово, по специально разработанной схеме:
- Проведение анализа цервикального мазка на предмет наличия или отсутствия измененных клеток (дисплазии) в организме пациента (ПАП тест).
- При положительной реакции на ПАП-тест проводят количественное определение вируса, его идентификацию (расширенный скрининг).
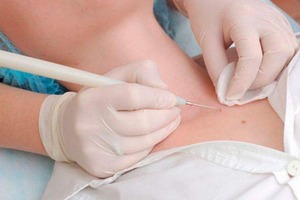
 Фото 1: Скрининг на ВПЧ ВКР показан всем женщинам, начиная с 24 летнего возраста. Проводится должен при прохождении плановой диспансеризации населения, при профессиональных медосмотрах, по личному обращению пациентки. Источник: flickr (Eugene Evehealth).
Фото 1: Скрининг на ВПЧ ВКР показан всем женщинам, начиная с 24 летнего возраста. Проводится должен при прохождении плановой диспансеризации населения, при профессиональных медосмотрах, по личному обращению пациентки. Источник: flickr (Eugene Evehealth).
Рекомендуемая периодичность мероприятия 1 раз в 3 года.
Обратите внимание! Скрининг позволяет снизить заболеваемость раком половых органов в сотни раз, что имеет важное значение при растущей тенденции заражения.
Показания для сдачи анализов
Показанием для сдачи анализов является:
- появление кондилом (иных новообразований) на половых органах, в анальной зоне или ротовой полости;
- выделения из половых органов неясной этиологии;
- личное беспокойство человека по поводу возможного заражения после незащищенного контакта;
- профилактический контроль.
Важность обследования
Важно! Выявление дисплазии тканей слизистых половых органов на ранней стадии имеет решающее значение при прогнозе эффективности терапии. Раннее выявление ВПЧ ВКР в организме позволяет принять превентивные терапевтические меры для его уничтожения.
От инфицирования до развития рака проходит от 5 до 15 лет. Выявление латентной формы присутствия вируса в организме дает:
- возможность динамического контроля состояния половых органов и деятельности вируса (вирусоносителям повторяют обследование ежегодно);
- возможность раннего лечения, когда прогноз наиболее благоприятен.
Статистика показывает, что рак шейки матки занимает 3 место среди онкологии половых органов женщины. Исследования причин развития онкопатологии матки подтверждают прямую связь между инфицированием ВПЧ ВКР и последующим развитием рака.
 Фото 2: Каждая 8 из 10 женщин, перешагнувших 50-летний рубеж, заражена или переболела ВПЧ. Эта цифра увеличивается год от года в связи с все большей сексуальной активностью населения. Источник: flickr (Eugene Evehealth).
Фото 2: Каждая 8 из 10 женщин, перешагнувших 50-летний рубеж, заражена или переболела ВПЧ. Эта цифра увеличивается год от года в связи с все большей сексуальной активностью населения. Источник: flickr (Eugene Evehealth).
Виды скрининга на ВПЧ ВКР
Наиболее информативной и недорогой является методика скрининга, которая используется в России – исследование на цитологию позволяет на первом этапе «отсеять» здоровых обследуемых, дальнейшее исследование проводить только пациентам с выявленной дисплазией тканей.
Анализ на цитологию (ПАП-тест)
ПАП-тест это анализ по методике Папаниколау.
Этот вид тестирования отличает высокая точность анализа.
Для проведения анализа делается забор материала из цервикального канала шейки матки у женщин или уретры у мужчин. Процедура безболезненная, проводится в условиях обычного осмотра.
Материал помещается либо на стекло (уходящая практика), либо в специальную жидкостную среду, что удобнее для проведения исследования.
Жидкостный ПАП-тест берется специальной щеточкой, которая помещается в подготовленную жидкую среду для транспортировки и хранения. Такая методика забора и хранения биоматериала позволяет сохранить и проанализировать все клетки взятого эпителия.
Как подготовиться к процедуре
Для того, чтобы ПАП-тест был максимально достоверным следует соблюдать несколько условий:
- за 2 дня до посещения врача отказаться от половых контактов, спринцеваний, введения вагинальных медицинских средств;
- женщинам визит следует планировать в первой половине менструального цикла, но после полного окончания месячного кровотечения;
- исследование не проводят в период обострения хронических инфекций или остропротекающих заболеваний;
- исследование не проводят непосредственно после курса антибактериальной или противовоспалительной медикаментозной терапии.
Расширенный скрининг
Обратите внимание! Расширенный скрининг представляет собой контролируемый забор биоматериала для проведения анализа в режиме реального времени на определение не только наличия или отсутствия ВПЧ, но и типа, количества папиллома вируса человека онкогенной группы.
Анализ проводится методом ПЦР качественного направления на основе RT-PCR.
Данная методика позволяет интерпретировать результаты анализов для расшифровки по Дайджин-тесту. И корректировать дальнейшую тактику работы с пациентом.
Забор биоматериала не отличается от обычного взятия мазка. Требования по подготовке к расширенному тестированию такие же как и к ПАП-тесту:
- Воздержание от применения лекарственных средств влагалищных за 2 суток до;
- Воздержание на этот же период от половых контактов;
- Отсутствие менструального кровотечения.
ПЦР анализ
Анализ выявления ВПЧ с использованием полимерно-цепной реакции (ПЦР-тест) на его ДНК обладает высокой степенью достоверности. С его помощью можно определить:
- факт инфицирования;
- генотип папилломавируса;
- степень распространения (количественный анализ).
Анализ возможен на любой жидкости из организма пациента: кровь, слизистое отделяемое, моча.
Подготовка
- Женщинам не следует сдавать биоматериал из влагалища во время менструации;
- Мужчинам запрещено мочиться за 1,5 часа до процедуры;
- Кровь сдают на голодный желудок;
- При заборе материала из половых органов женщинам запрещено спринцеваться накануне вечером;
- Исключаются любые медикаменты за 2 дня до проведения забора биоматериала.
Результаты анализов
- Тест по Папаниколау (ПАП-тест) может быть отрицательным (измененные клетки не обнаружены) или положительным (во взятом образце обнаружены онкоклетки);
- ПЦР-тест показывает наличие или отсутствие ВПЧ;
- Расширенный скрининг определяет тип вируса и его количество.
Количественный результат по Дайджин-тесту интерпретируется:
- менее 3 Lg – концентрация вируса незначительная;
- от 3 Lg до 5 Lg – средняя степень присутствия;
- более 5 Lg – высокая концентрация ВПЧ.
Источник
Папилломавирус человека (ВПЧ), Human papillomavirus (HPV) принадлежит к семейству паповавирусов (Papovaviridae), роду папилломавирусов. Это ДНК-содержащий мелкий вирус, термостабильный. Является самой распространенной инфекцией, передающейся половым путем: по некоторым данным, в молодом возрасте отмечается инфицирование до 80% населения. Вирус проявляет тропность к эпителию кожи, слизистых оболочек гениталий и других органов (гортань, ротовая полость, слизистая конъюнктивы).
Основной путь передачи — половые контакты, включая анальный, оральный секс, к сожалению, использование презервативов не защищает от инфицирования данным вирусом. Возможна передача при тесном контакте кожи, слизистых оболочек с инфицированными областями. Важным фактором инфицирования новорожденного с последующим развитием респираторного папилломатоза гортани является инфицирование при прохождении по половым путям во время родоразрешения. На сегодняшний день известно более 100 видов вируса папилломы человека (ВПЧ) и из них более 40 могут вызвать поражение аногенитального тракта (половые органы и задний проход) мужчин и женщин и появление остроконечных кондилом. Папилломавирусы можно разделить на 3 основные группы:
неонкогенные ВПЧ (1, 2, 3, 5 генотипы);
низкого канцерогенного риска (НКР) ВПЧ (6, 11, 42, 43, 44 генотипы);
высокого канцерогенного риска (ВКР) ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 генотипы).
ВПЧ низкого канцерогенного риска (ВПЧ НКР): группа вирусов, которая приводит к доброкачественным поражениям, представлена 5 генотипами, но основными являются 6 и 11, которые составляют до 90% всех случаев инфицирования данными вирусами. Наиболее частые клинические проявление ВПЧ НКР- это остроконечные кондиломы (Condylomata acuminata). Также выделяют еще разновидности остроконечных кондилом: кератотические бородавки с локализацией на сухой коже, папулезные бородавки с локализацией на полностью ороговевшем эпителии, гигантская кондилома Бушке-Левенштейна (встречающаяся у больных сниженным клеточным иммунитетом или при беременности). Эндоуретральные кондиломы локализуются в уретре, часто сочетаются с обычными кондиломами и встречаются преимущественно у мужчин. Кондиломы шейки матки часто сочетаются с генитальными кондиломами: экзофитные кондиломы, эндофитные (плоские).
ВПЧ высокого канцерогенного риска (ВПЧ ВКР): группа типов высокого канцерогенного риска представлена 15 генотипами, наиболее распространенными из которых являются десять: 16, 18, 31, 33, 35, 39, 45, 52, 58, 59. При этом на долю 16 и 18 типов приходится 70% всех случаев инфицирования, и именно данные типы характеризуются высоким канцерогенным потенциалом, в отношении 18 генотипа наблюдается высокая частота выявления при аденокарциномах. На сегодняшний день доказана роль ВПЧ в развитии рака шейки матки, большей доли рака заднего прохода (около 90% случаев), около 40% всех случаев рака влагалища, вульвы, полового члена, 10–15% случаев рака ротовой полости и гортани.
Вирусная ДНК способна персистировать в клетке в двух формах: эписомальной (продуктивная стадия) и интегрированной (интегрированная стадия). На эписомальной стадии происходит усиленная продукция новых вирусов, что способствует вовлечению в патологический процесс новых клеток, однако клетки не теряют контроль над процессами апоптоза и эта стадия характеризуется доброкачественными изменениями со стороны эпителия. Интегрированная стадия — это стадия, когда вирус встраивается в геном клетки и приводит к суперэкспрессии онкобелков Е6, Е7, ассоциируется с предраковыми изменениями и требует соответствующей тактики лечения пациента.
Инфекция, вызываемая вирусом папилломы человека, имеет ряд важных особенностей, без учета которых использование ВПЧ-тестирования сопряжено с рядом трудностей в трактовке результатов.
С одной стороны:
ВПЧ является самой распространенной ИППП (до 80% лиц молодого возраста инфицированы данным вирусом);
при инфицировании большинство женщин (около 80%) излечиваются от ВПЧ в течение 9–15 месяцев от момента заражения без проведения лечебных процедур (т. е., при повторении теста на генотипирование через год возможно исчезновение выявленного ранее генотипа ВПЧ или изменение спектра генотипов). С возрастом способность к самоэлиминации значительно снижается;
инфицирование ВПЧ и заболевание — НЕ СИНОНИМЫ! Инфекция приводит к развитию предрака у малой части инфицированных женщин (около 0,5%);
от заражения до развития предрака и РШМ, в среднем, проходит 10–20 лет. С возрастом способность к элиминации вируса снижается, соответственно, повышается риск развития предрака и рака;
отсутствуют эффективные методы лечения на стадии латентной инфекции (нет изменений в цитологической и/или кольпоскопической картине, но выявляется вирус).
С другой стороны:
ВПЧ является основной причиной рака шейки матки. Инфицированные женщины имеют в 300 раз более высокий риск развития рака. Разработаны не только методы вторичной профилактики (цервикальный скрининг для выявления предраковых стадий), но и первичной — вакцинация девочек и мальчиков в возрасте 9–12 лет;
инфекция коварна и довольно часто не вызывает никаких жалоб у пациента и не выявляется при осмотре до перехода в стадию инвазивного рака;
клинические проявления папилломавирусной инфекции высокого риска могут маскироваться другими заболеваниями урогенитального тракта, что не позволяет вовремя выявить их с использованием традиционных методов.
Из перечисленных особенностей папилломавирусной инфекции следует, что:
1. Положительный результат тестирования на наличие вируса должен трактоваться как:
принадлежность пациента к группе высокого риска по развитию рака шейки матки;
потребность в дополнительных тщательных диагностических процедурах для выяснения текущей стадии инфекции, исключения тяжелой дисплазии и рака шейки матки;
необходимость в наблюдении за инфекцией (персистенцией) при отсутствии клинических или субклинических проявлений.
2. Отрицательный результат тестирования трактуется как отсутствие риска развития тяжелой дисплазии и рака.
Лабораторная диагностика. Диагностика ВПЧ инфицирования определяется клиническими проявлениями и клиническими задачами прогноза риска развития ВПЧ-ассоциированных злокачественных новообразований.
Лабораторные методы диагностики ВПЧ инфекции:
прямые методы: оценка наличия койлоцитов в цитологических мазках (низкая диагностическая чувствительность); выявление наличия маркеров пролиферации р16/ki 67; молекулярные методы (ПЦР анализ), которые проводятся в формате качественного и количественного тестирования с возможностью генотипирования, определение генотипов НКР и ВКР ВПЧ;
серологические методы не используются для диагностики ВПЧ инфекции.
Стратегии использования ВПЧ-тестов в диагностике предрака и рака шейки матки:
входит в комплекс цервикального скрининга: в качестве теста сортировки патологических ПАП тестов у женщин до 30 лет; тест совместно с цитологическим исследованием для всех женщин старше 30 лет. В данном случае наличие инфицирования ВПЧ (особенно, 16 и 18 генотипом, с высокой вирусной нагрузкой) позволяет прогнозировать высокий риск наличия или развития РШМ, что определяет необходимость дополнительных обследований. В случае отрицательных результатов ВПЧ тестирования, периодичность скрининга может быть увеличена до 3–5 лет (в разных странах действуют различные рекомендации) при условии отсутствия изменений в цитологическом исследовании;
рекомендован в некоторых странах как тест первичного скрининга на РШМ у женщин старше 30 лет;
контроль эффективности лечения дисплазий (первое исследование проводится через 6 месяцев после лечения совместно с ПАП тестом). При этом в случае получения положительных результатов ВПЧ теста и нормальной цитологии, необходимо дополнительное обследование, т. к. риск наличия или развития патологии высокий.
Различные методы молекулярной диагностики (ПЦР анализа) позволяют решить различные диагностические задачи:
качественный формат позволяет выявить наличие инфицирования, однако не позволяет оценить клинически значимые количества вируса, которые ассоциируются с высоким риском наличия предраковых поражений;
количественный формат позволяет выявить вирус, определить вирусную нагрузку. Это позволяет оценить не только степень риска, но и возможное уже наличие предраковых изменений, т. к. высокая вирусная нагрузка ассоциируется с реализацией онкогенного потенциала вируса. При правильном и стандартизированном заборе клинического материала вирусная нагрузка менее 105 геномных эквивалентов (ГЭ) ВПЧ ВКР в соскобе (Josefsson et al, 2000; van Duin et al, 2002; Dalstein et al, 2003; Snijders et al, 2003; Moberg et al, 2004, 2005) или 103 ГЭ приходящихся на 100 тыс. клеток человека считается клинически малозначимой, так как практически не встречается при тяжелой дисплазии и РШМ, а также ассоциирована с минимальным риском их развития. Напротив, количество вируса более 105 ГЭ, приходящихся на 100 тыс. клеток при установленном факте персистентного течения инфекции (ВПЧ выявляется более 1 года), обозначается как повышенная нагрузка ВПЧ и ассоциировано с повышенным риском развития тяжелой дисплазии и чаще встречается при РШМ. Наконец, определенной информацией обладает мониторинг вирусной нагрузки. Так, считается, что снижение количества ДНК ВПЧ более чем на 1 lg может являться маркером транзиторной инфекции. Рост вирусной нагрузки через 3, 6 и 9 мес. после проведенного лечения свидетельствует о возможности рецидива.
Генотипирование ВПЧ дает дополнительные возможности определения прогноза течения заболевания. Необходимость генотипирования может быть оправдана, т. к.:
выявление нескольких генотипов вируса ассоциировано с менее благоприятным прогнозом течения заболевания и более высоким риском персистенции;
степень онкогенности различных генотипов высокого риска не одинакова. Наибольшей онкогенностью обладают 16 и 18 типы ВПЧ, существуют рекомендации по проведению определения этих двух генотипов вируса после теста на широкий спектр типов с целью более агрессивной тактики ведения пациентов: при выявлении 16 и 18 генотипов рекомендуется сразу проводить кольпоскопическое обследование, при выявлении других типов высокого риска — сначала проводить цитологию, и только при положительном результате цитологии проводить кольпоскопию;
проведение генотипирования позволяет отличить реинфицирование от персистирования инфекции при повторном визите пациента. Получать подобную информацию тем более важно, так как опасность представляет именно хроническая персистентная форма инфекции, недавнее же инфицирование, наиболее вероятно, спонтанно излечивается. О реинфицировании говорит изменение спектра генотипов, о персистирующей инфекции — сохранение генотипа вируса через год после первого тестирования; повторное инфицирование тем же генотипом вируса после самостоятельного излечения практически невозможно.
Источник
Ïàïèëëîìàâèðóñ ÷åëîâåêà (ÂÏ×), Human papillomavirus (HPV) ïðèíàäëåæèò ê ñåìåéñòâó ïàïîâàâèðóñîâ (Papovaviridae), ðîäó ïàïèëëîìàâèðóñîâ. Ýòî ÄÍÊ-ñîäåðæàùèé ìåëêèé âèðóñ, òåðìîñòàáèëüíûé. ßâëÿåòñÿ ñàìîé ðàñïðîñòðàíåííîé èíôåêöèåé, ïåðåäàþùåéñÿ ïîëîâûì ïóòåì: ïî íåêîòîðûì äàííûì, â ìîëîäîì âîçðàñòå îòìå÷àåòñÿ èíôèöèðîâàíèå äî 80% íàñåëåíèÿ. Âèðóñ ïðîÿâëÿåò òðîïíîñòü ê ýïèòåëèþ êîæè, ñëèçèñòûõ îáîëî÷åê ãåíèòàëèé è äðóãèõ îðãàíîâ (ãîðòàíü, ðîòîâàÿ ïîëîñòü, ñëèçèñòàÿ êîíúþíêòèâû).
Îñíîâíîé ïóòü ïåðåäà÷è — ïîëîâûå êîíòàêòû, âêëþ÷àÿ àíàëüíûé, îðàëüíûé ñåêñ, ê ñîæàëåíèþ, èñïîëüçîâàíèå ïðåçåðâàòèâîâ íå çàùèùàåò îò èíôèöèðîâàíèÿ äàííûì âèðóñîì. Âîçìîæíà ïåðåäà÷à ïðè òåñíîì êîíòàêòå êîæè, ñëèçèñòûõ îáîëî÷åê ñ èíôèöèðîâàííûìè îáëàñòÿìè. Âàæíûì ôàêòîðîì èíôèöèðîâàíèÿ íîâîðîæäåííîãî ñ ïîñëåäóþùèì ðàçâèòèåì ðåñïèðàòîðíîãî ïàïèëëîìàòîçà ãîðòàíè ÿâëÿåòñÿ èíôèöèðîâàíèå ïðè ïðîõîæäåíèè ïî ïîëîâûì ïóòÿì âî âðåìÿ ðîäîðàçðåøåíèÿ. Íà ñåãîäíÿøíèé äåíü èçâåñòíî áîëåå 100 âèäîâ âèðóñà ïàïèëëîìû ÷åëîâåêà (ÂÏ×) è èç íèõ áîëåå 40 ìîãóò âûçâàòü ïîðàæåíèå àíîãåíèòàëüíîãî òðàêòà (ïîëîâûå îðãàíû è çàäíèé ïðîõîä) ìóæ÷èí è æåíùèí è ïîÿâëåíèå îñòðîêîíå÷íûõ êîíäèëîì. Ïàïèëëîìàâèðóñû ìîæíî ðàçäåëèòü íà 3 îñíîâíûå ãðóïïû:
- íåîíêîãåííûå ÂÏ× (1, 2, 3, 5 ãåíîòèïû);
- íèçêîãî êàíöåðîãåííîãî ðèñêà (ÍÊÐ) ÂÏ× (6, 11, 42, 43, 44 ãåíîòèïû);
- âûñîêîãî êàíöåðîãåííîãî ðèñêà (ÂÊÐ) ÂÏ× (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 è 68 ãåíîòèïû).
ÂÏ× íèçêîãî êàíöåðîãåííîãî ðèñêà (ÂÏ× ÍÊÐ): ãðóïïà âèðóñîâ, êîòîðàÿ ïðèâîäèò ê äîáðîêà÷åñòâåííûì ïîðàæåíèÿì, ïðåäñòàâëåíà 5 ãåíîòèïàìè, íî îñíîâíûìè ÿâëÿþòñÿ 6 è 11, êîòîðûå ñîñòàâëÿþò äî 90% âñåõ ñëó÷àåâ èíôèöèðîâàíèÿ äàííûìè âèðóñàìè. Íàèáîëåå ÷àñòûå êëèíè÷åñêèå ïðîÿâëåíèå ÂÏ× ÍÊÐ- ýòî îñòðîêîíå÷íûå êîíäèëîìû (Condylomata acuminata). Òàêæå âûäåëÿþò åùå ðàçíîâèäíîñòè îñòðîêîíå÷íûõ êîíäèëîì: êåðàòîòè÷åñêèå áîðîäàâêè ñ ëîêàëèçàöèåé íà ñóõîé êîæå, ïàïóëåçíûå áîðîäàâêè ñ ëîêàëèçàöèåé íà ïîëíîñòüþ îðîãîâåâøåì ýïèòåëèè, ãèãàíòñêàÿ êîíäèëîìà Áóøêå-Ëåâåíøòåéíà (âñòðå÷àþùàÿñÿ ó áîëüíûõ ñíèæåííûì êëåòî÷íûì èììóíèòåòîì èëè ïðè áåðåìåííîñòè). Ýíäîóðåòðàëüíûå êîíäèëîìû ëîêàëèçóþòñÿ â óðåòðå, ÷àñòî ñî÷åòàþòñÿ ñ îáû÷íûìè êîíäèëîìàìè è âñòðå÷àþòñÿ ïðåèìóùåñòâåííî ó ìóæ÷èí. Êîíäèëîìû øåéêè ìàòêè ÷àñòî ñî÷åòàþòñÿ ñ ãåíèòàëüíûìè êîíäèëîìàìè: ýêçîôèòíûå êîíäèëîìû, ýíäîôèòíûå (ïëîñêèå).
ÂÏ× âûñîêîãî êàíöåðîãåííîãî ðèñêà (ÂÏ× ÂÊÐ): ãðóïïà òèïîâ âûñîêîãî êàíöåðîãåííîãî ðèñêà ïðåäñòàâëåíà 15 ãåíîòèïàìè, íàèáîëåå ðàñïðîñòðàíåííûìè èç êîòîðûõ ÿâëÿþòñÿ äåñÿòü: 16, 18, 31, 33, 35, 39, 45, 52, 58, 59. Ïðè ýòîì íà äîëþ 16 è 18 òèïîâ ïðèõîäèòñÿ 70% âñåõ ñëó÷àåâ èíôèöèðîâàíèÿ, è èìåííî äàííûå òèïû õàðàêòåðèçóþòñÿ âûñîêèì êàíöåðîãåííûì ïîòåíöèàëîì, â îòíîøåíèè 18 ãåíîòèïà íàáëþäàåòñÿ âûñîêàÿ ÷àñòîòà âûÿâëåíèÿ ïðè àäåíîêàðöèíîìàõ. Íà ñåãîäíÿøíèé äåíü äîêàçàíà ðîëü ÂÏ× â ðàçâèòèè ðàêà øåéêè ìàòêè, áîëüøåé äîëè ðàêà çàäíåãî ïðîõîäà (îêîëî 90% ñëó÷àåâ), îêîëî 40% âñåõ ñëó÷àåâ ðàêà âëàãàëèùà, âóëüâû, ïîëîâîãî ÷ëåíà, 10–15% ñëó÷àåâ ðàêà ðîòîâîé ïîëîñòè è ãîðòàíè.
Âèðóñíàÿ ÄÍÊ ñïîñîáíà ïåðñèñòèðîâàòü â êëåòêå â äâóõ ôîðìàõ: ýïèñîìàëüíîé (ïðîäóêòèâíàÿ ñòàäèÿ) è èíòåãðèðîâàííîé (èíòåãðèðîâàííàÿ ñòàäèÿ). Íà ýïèñîìàëüíîé ñòàäèè ïðîèñõîäèò óñèëåííàÿ ïðîäóêöèÿ íîâûõ âèðóñîâ, ÷òî ñïîñîáñòâóåò âîâëå÷åíèþ â ïàòîëîãè÷åñêèé ïðîöåññ íîâûõ êëåòîê, îäíàêî êëåòêè íå òåðÿþò êîíòðîëü íàä ïðîöåññàìè àïîïòîçà è ýòà ñòàäèÿ õàðàêòåðèçóåòñÿ äîáðîêà÷åñòâåííûìè èçìåíåíèÿìè ñî ñòîðîíû ýïèòåëèÿ. Èíòåãðèðîâàííàÿ ñòàäèÿ — ýòî ñòàäèÿ, êîãäà âèðóñ âñòðàèâàåòñÿ â ãåíîì êëåòêè è ïðèâîäèò ê ñóïåðýêñïðåññèè îíêîáåëêîâ Å6, Å7, àññîöèèðóåòñÿ ñ ïðåäðàêîâûìè èçìåíåíèÿìè è òðåáóåò ñîîòâåòñòâóþùåé òàêòèêè ëå÷åíèÿ ïàöèåíòà.
Èíôåêöèÿ, âûçûâàåìàÿ âèðóñîì ïàïèëëîìû ÷åëîâåêà, èìååò ðÿä âàæíûõ îñîáåííîñòåé, áåç ó÷åòà êîòîðûõ èñïîëüçîâàíèå ÂÏ×-òåñòèðîâàíèÿ ñîïðÿæåíî ñ ðÿäîì òðóäíîñòåé â òðàêòîâêå ðåçóëüòàòîâ.
Ñ îäíîé ñòîðîíû:
- ÂÏ× ÿâëÿåòñÿ ñàìîé ðàñïðîñòðàíåííîé ÈÏÏÏ (äî 80% ëèö ìîëîäîãî âîçðàñòà èíôèöèðîâàíû äàííûì âèðóñîì);
- ïðè èíôèöèðîâàíèè áîëüøèíñòâî æåíùèí (îêîëî 80%) èçëå÷èâàþòñÿ îò ÂÏ× â òå÷åíèå 9–15 ìåñÿöåâ îò ìîìåíòà çàðàæåíèÿ áåç ïðîâåäåíèÿ ëå÷åáíûõ ïðîöåäóð (ò. å., ïðè ïîâòîðåíèè òåñòà íà ãåíîòèïèðîâàíèå ÷åðåç ãîä âîçìîæíî èñ÷åçíîâåíèå âûÿâëåííîãî ðàíåå ãåíîòèïà ÂÏ× èëè èçìåíåíèå ñïåêòðà ãåíîòèïîâ). Ñ âîçðàñòîì ñïîñîáíîñòü ê ñàìîýëèìèíàöèè çíà÷èòåëüíî ñíèæàåòñÿ;
- èíôèöèðîâàíèå ÂÏ× è çàáîëåâàíèå — ÍÅ ÑÈÍÎÍÈÌÛ! Èíôåêöèÿ ïðèâîäèò ê ðàçâèòèþ ïðåäðàêà ó ìàëîé ÷àñòè èíôèöèðîâàííûõ æåíùèí (îêîëî 0,5%);
- îò çàðàæåíèÿ äî ðàçâèòèÿ ïðåäðàêà è ÐØÌ, â ñðåäíåì, ïðîõîäèò 10–20 ëåò. Ñ âîçðàñòîì ñïîñîáíîñòü ê ýëèìèíàöèè âèðóñà ñíèæàåòñÿ, ñîîòâåòñòâåííî, ïîâûøàåòñÿ ðèñê ðàçâèòèÿ ïðåäðàêà è ðàêà;
- îòñóòñòâóþò ýôôåêòèâíûå ìåòîäû ëå÷åíèÿ íà ñòàäèè ëàòåíòíîé èíôåêöèè (íåò èçìåíåíèé â öèòîëîãè÷åñêîé è/èëè êîëüïîñêîïè÷åñêîé êàðòèíå, íî âûÿâëÿåòñÿ âèðóñ).
Ñ äðóãîé ñòîðîíû:
- ÂÏ× ÿâëÿåòñÿ îñíîâíîé ïðè÷èíîé ðàêà øåéêè ìàòêè. Èíôèöèðîâàííûå æåíùèíû èìåþò â 300 ðàç áîëåå âûñîêèé ðèñê ðàçâèòèÿ ðàêà. Ðàçðàáîòàíû íå òîëüêî ìåòîäû âòîðè÷íîé ïðîôèëàêòèêè (öåðâèêàëüíûé ñêðèíèíã äëÿ âûÿâëåíèÿ ïðåäðàêîâûõ ñòàäèé), íî è ïåðâè÷íîé — âàêöèíàöèÿ äåâî÷åê è ìàëü÷èêîâ â âîçðàñòå 9–12 ëåò;
- èíôåêöèÿ êîâàðíà è äîâîëüíî ÷àñòî íå âûçûâàåò íèêàêèõ æàëîá ó ïàöèåíòà è íå âûÿâëÿåòñÿ ïðè îñìîòðå äî ïåðåõîäà â ñòàäèþ èíâàçèâíîãî ðàêà;
- êëèíè÷åñêèå ïðîÿâëåíèÿ ïàïèëëîìàâèðóñíîé èíôåêöèè âûñîêîãî ðèñêà ìîãóò ìàñêèðîâàòüñÿ äðóãèìè çàáîëåâàíèÿìè óðîãåíèòàëüíîãî òðàêòà, ÷òî íå ïîçâîëÿåò âîâðåìÿ âûÿâèòü èõ ñ èñïîëüçîâàíèåì òðàäèöèîííûõ ìåòîäîâ.
Èç ïåðå÷èñëåííûõ îñîáåííîñòåé ïàïèëëîìàâèðóñíîé èíôåêöèè ñëåäóåò, ÷òî:
1. Ïîëîæèòåëüíûé ðåçóëüòàò òåñòèðîâàíèÿ íà íàëè÷èå âèðóñà äîëæåí òðàêòîâàòüñÿ êàê:
- ïðèíàäëåæíîñòü ïàöèåíòà ê ãðóïïå âûñîêîãî ðèñêà ïî ðàçâèòèþ ðàêà øåéêè ìàòêè;
- ïîòðåáíîñòü â äîïîëíèòåëüíûõ òùàòåëüíûõ äèàãíîñòè÷åñêèõ ïðîöåäóðàõ äëÿ âûÿñíåíèÿ òåêóùåé ñòàäèè èíôåêöèè, èñêëþ÷åíèÿ òÿæåëîé äèñïëàçèè è ðàêà øåéêè ìàòêè;
- íåîáõîäèìîñòü â íàáëþäåíèè çà èíôåêöèåé (ïåðñèñòåíöèåé) ïðè îòñóòñòâèè êëèíè÷åñêèõ èëè ñóáêëèíè÷åñêèõ ïðîÿâëåíèé.
2. Îòðèöàòåëüíûé ðåçóëüòàò òåñòèðîâàíèÿ òðàêòóåòñÿ êàê îòñóòñòâèå ðèñêà ðàçâèòèÿ òÿæåëîé äèñïëàçèè è ðàêà.
Ëàáîðàòîðíàÿ äèàãíîñòèêà. Äèàãíîñòèêà ÂÏ× èíôèöèðîâàíèÿ îïðåäåëÿåòñÿ êëèíè÷åñêèìè ïðîÿâëåíèÿìè è êëèíè÷åñêèìè çàäà÷àìè ïðîãíîçà ðèñêà ðàçâèòèÿ ÂÏ×-àññîöèèðîâàííûõ çëîêà÷åñòâåííûõ íîâîîáðàçîâàíèé.
Ëàáîðàòîðíûå ìåòîäû äèàãíîñòèêè ÂÏ× èíôåêöèè:
- ïðÿìûå ìåòîäû: îöåíêà íàëè÷èÿ êîéëîöèòîâ â öèòîëîãè÷åñêèõ ìàçêàõ (íèçêàÿ äèàãíîñòè÷åñêàÿ ÷óâñòâèòåëüíîñòü); âûÿâëåíèå íàëè÷èÿ ìàðêåðîâ ïðîëèôåðàöèè ð16/ki 67; ìîëåêóëÿðíûå ìåòîäû (ÏÖÐ àíàëèç), êîòîðûå ïðîâîäÿòñÿ â ôîðìàòå êà÷åñòâåííîãî è êîëè÷åñòâåííîãî òåñòèðîâàíèÿ ñ âîçìîæíîñòüþ ãåíîòèïèðîâàíèÿ, îïðåäåëåíèå ãåíîòèïîâ ÍÊÐ è ÂÊÐ ÂÏ×;
- ñåðîëîãè÷åñêèå ìåòîäû íå èñïîëüçóþòñÿ äëÿ äèàãíîñòèêè ÂÏ× èíôåêöèè.
Ñòðàòåãèè èñïîëüçîâàíèÿ ÂÏ×-òåñòîâ â äèàãíîñòèêå ïðåäðàêà è ðàêà øåéêè ìàòêè:
- âõîäèò â êîìïëåêñ öåðâèêàëüíîãî ñêðèíèíãà: â êà÷åñòâå òåñòà ñîðòèðîâêè ïàòîëîãè÷åñêèõ ÏÀÏ òåñòîâ ó æåíùèí äî 30 ëåò; òåñò ñîâìåñòíî ñ öèòîëîãè÷åñêèì èññëåäîâàíèåì äëÿ âñåõ æåíùèí ñòàðøå 30 ëåò.  äàííîì ñëó÷àå íàëè÷èå èíôèöèðîâàíèÿ ÂÏ× (îñîáåííî, 16 è 18 ãåíîòèïîì, ñ âûñîêîé âèðóñíîé íàãðóçêîé) ïîçâîëÿåò ïðîãíîçèðîâàòü âûñîêèé ðèñê íàëè÷èÿ èëè ðàçâèòèÿ ÐØÌ, ÷òî îïðåäåëÿåò íåîáõîäèìîñòü äîïîëíèòåëüíûõ îáñëåäîâàíèé.  ñëó÷àå îòðèöàòåëüíûõ ðåçóëüòàòîâ ÂÏ× òåñòèðîâàíèÿ, ïåðèîäè÷íîñòü ñêðèíèíãà ìîæåò áûòü óâåëè÷åíà äî 3–5 ëåò (â ðàçíûõ ñòðàíàõ äåéñòâóþò ðàçëè÷íûå ðåêîìåíäàöèè) ïðè óñëîâèè îòñóòñòâèÿ èçìåíåíèé â öèòîëîãè÷åñêîì èññëåäîâàíèè;
- ðåêîìåíäîâàí â íåêîòîðûõ ñòðàíàõ êàê òåñò ïåðâè÷íîãî ñêðèíèíãà íà ÐØÌ ó æåíùèí ñòàðøå 30 ëåò;
- êîíòðîëü ýôôåêòèâíîñòè ëå÷åíèÿ äèñïëàçèé (ïåðâîå èññëåäîâàíèå ïðîâîäèòñÿ ÷åðåç 6 ìåñÿöåâ ïîñëå ëå÷åíèÿ ñîâìåñòíî ñ ÏÀÏ òåñòîì). Ïðè ýòîì â ñëó÷àå ïîëó÷åíèÿ ïîëîæèòåëüíûõ ðåçóëüòàòîâ ÂÏ× òåñòà è íîðìàëüíîé öèòîëîãèè, íåîáõîäèìî äîïîëíèòåëüíîå îáñëåäîâàíèå, ò. ê. ðèñê íàëè÷èÿ èëè ðàçâèòèÿ ïàòîëîãèè âûñîêèé.
Ðàçëè÷íûå ìåòîäû ìîëåêóëÿðíîé äèàãíîñòèêè (ÏÖÐ àíàëèçà) ïîçâîëÿþò ðåøèòü ðàçëè÷íûå äèàãíîñòè÷åñêèå çàäà÷è:
- êà÷åñòâåííûé ôîðìàò ïîçâîëÿåò âûÿâèòü íàëè÷èå èíôèöèðîâàíèÿ, îäíàêî íå ïîçâîëÿåò îöåíèòü êëèíè÷åñêè çíà÷èìûå êîëè÷åñòâà âèðóñà, êîòîðûå àññîöèèðóþòñÿ ñ âûñîêèì ðèñêîì íàëè÷èÿ ïðåäðàêîâûõ ïîðàæåíèé;
- êîëè÷åñòâåííûé ôîðìàò ïîçâîëÿåò âûÿâèòü âèðóñ, îïðåäåëèòü âèðóñíóþ íàãðóçêó. Ýòî ïîçâîëÿåò îöåíèòü íå òîëüêî ñòåïåíü ðèñêà, íî è âîçìîæíîå óæå íàëè÷èå ïðåäðàêîâûõ èçìåíåíèé, ò. ê. âûñîêàÿ âèðóñíàÿ íàãðóçêà àññîöèèðóåòñÿ ñ ðåàëèçàöèåé îíêîãåííîãî ïîòåíöèàëà âèðóñà. Ïðè ïðàâèëüíîì è ñòàíäàðòèçèðîâàííîì çàáîðå êëèíè÷åñêîãî ìàòåðèàëà âèðóñíàÿ íàãðóçêà ìåíåå 105 ãåíîìíûõ ýêâèâàëåíòîâ (ÃÝ) ÂÏ× ÂÊÐ â ñîñêîáå (Josefsson et al, 2000; van Duin et al, 2002; Dalstein et al, 2003; Snijders et al, 2003; Moberg et al, 2004, 2005) èëè 103 ÃÝ ïðèõîäÿùèõñÿ íà 100 òûñ. êëåòîê ÷åëîâåêà ñ÷èòàåòñÿ êëèíè÷åñêè ìàëîçíà÷èìîé, òàê êàê ïðàêòè÷åñêè íå âñòðå÷àåòñÿ ïðè òÿæåëîé äèñïëàçèè è ÐØÌ, à òàêæå àññîöèèðîâàíà ñ ìèíèìàëüíûì ðèñêîì èõ ðàçâèòèÿ. Íàïðîòèâ, êîëè÷åñòâî âèðóñà áîëåå 105 ÃÝ, ïðèõîäÿùèõñÿ íà 100 òûñ. êëåòîê ïðè óñòàíîâëåííîì ôàêòå ïåðñèñòåíòíîãî òå÷åíèÿ èíôåêöèè (ÂÏ× âûÿâëÿåòñÿ áîëåå 1 ãîäà), îáîçíà÷àåòñÿ êàê ïîâûøåííàÿ íàãðóçêà ÂÏ× è àññîöèèðîâàíî ñ ïîâûøåííûì ðèñêîì ðàçâèòèÿ òÿæåëîé äèñïëàçèè è ÷àùå âñòðå÷àåòñÿ ïðè ÐØÌ. Íàêîíåö, îïðåäåëåííîé èíôîðìàöèåé îáëàäàåò ìîíèòîðèíã âèðóñíîé íàãðóçêè. Òàê, ñ÷èòàåòñÿ, ÷òî ñíèæåíèå êîëè÷åñòâà ÄÍÊ ÂÏ× áîëåå ÷åì íà 1 lg ìîæåò ÿâëÿòüñÿ ìàðêåðîì òðàíçèòîðíîé èíôåêöèè. Ðîñò âèðóñíîé íàãðóçêè ÷åðåç 3, 6 è 9 ìåñ. ïîñëå ïðîâåäåííîãî ëå÷åíèÿ ñâèäåòåëüñòâóåò î âîçìîæíîñòè ðåöèäèâà.
Ãåíîòèïèðîâàíèå ÂÏ× äàåò äîïîëíèòåëüíûå âîçìîæíîñòè îïðåäåëåíèÿ ïðîãíîçà òå÷åíèÿ çàáîëåâàíèÿ. Íåîáõîäèìîñòü ãåíîòèïèðîâàíèÿ ìîæåò áûòü îïðàâäàíà, ò. ê.:
- âûÿâëåíèå íåñêîëüêèõ ãåíîòèïîâ âèðóñà àññîöèèðîâàíî ñ ìåíåå áëàãîïðèÿòíûì ïðîãíîçîì òå÷åíèÿ çàáîëåâàíèÿ è áîëåå âûñîêèì ðèñêîì ïåðñèñòåíöèè;
- ñòåïåíü îíêîãåííîñòè ðàçëè÷íûõ ãåíîòèïîâ âûñîêîãî ðèñêà íå îäèíàêîâà. Íàèáîëüøåé îíêîãåííîñòüþ îáëàäàþò 16 è 18 òèïû ÂÏ×, ñóùåñòâóþò ðåêîìåíäàöèè ïî ïðîâåäåíèþ îïðåäåëåíèÿ ýòèõ äâóõ ãåíîòèïîâ âèðóñà ïîñëå òåñòà íà øèðîêèé ñïåêòð òèïîâ ñ öåëüþ áîëåå àãðåññèâíîé òàêòèêè âåäåíèÿ ïàöèåíòîâ: ïðè âûÿâëåíèè 16 è 18 ãåíîòèïîâ ðåêîìåíäóåòñÿ ñðàçó ïðîâîäèòü êîëüïîñêîïè÷åñêîå îáñëåäîâàíèå, ïðè âûÿâëåíèè äðóãèõ òèïîâ âûñîêîãî ðèñêà — ñíà÷àëà ïðîâîäèòü öèòîëîãèþ, è òîëüêî ïðè ïîëîæèòåëüíîì ðåçóëüòàòå öèòîëîãèè ïðîâîäèòü êîëüïîñêîïèþ;
- ïðîâåäåíèå ãåíîòèïèðîâàíèÿ ïîçâîëÿåò îòëè÷èòü ðåèíôèöèðîâàíèå îò ïåðñèñòèðîâàíèÿ èíôåêöèè ïðè ïîâòîðíîì âèçèòå ïàöèåíòà. Ïîëó÷àòü ïîäîáíóþ èíôîðìàöèþ òåì áîëåå âàæíî, òàê êàê îïàñíîñòü ïðåäñòàâëÿåò èìåííî õðîíè÷åñêàÿ ïåðñèñòåíòíàÿ ôîðìà èíôåêöèè, íåäàâíåå æå èíôèöèðîâàíèå, íàèáîëåå âåðîÿòíî, ñïîíòàííî èçëå÷èâàåòñÿ. Î ðåèíôèöèðîâàíèè ãîâîðèò èçìåíåíèå ñïåêòðà ãåíîòèïîâ, î ïåðñèñòèðóþùåé èíôåêöèè — ñîõðàíåíèå ãåíîòèïà âèðóñà ÷åðåç ãîä ïîñëå ïåðâîãî òåñòèðîâàíèÿ; ïîâòîðíîå èíôèöèðîâàíèå òåì æå ãåíîòèïîì âèðóñà ïîñëå ñàìîñòîÿòåëüíîãî èçëå÷åíèÿ ïðàêòè÷åñêè íåâîçìîæíî.
Ïðåèìóùåñòâà ÂÏ×-òåñòèðîâàíèÿ ïî ñðàâíåíèþ ñ öèòîëîãèåé:
- Ñóùåñòâåííî âûøå äèàãíîñòè÷åñêàÿ ÷óâñòâèòåëüíîñòü ïî îòíîøåíèþ ê òÿæåëîé äèñïëàçèè è ÐØÌ (93–99%), äëÿ öèòîëîãè÷åñêîãî àíàëèçà ìàçêà ÷óâñòâèòåëüíîñòü — 50–60%.
- Ñóùåñòâåííî âûøå ïðåäñêàçàòåëüíàÿ öåííîñòü îòðèöàòåëüíîãî ðåçóëüòàòà.
Îñîáåííîñòè òåñòèðîâàíèÿ íà ÂÏ×
Èññëåäîâàíèå íà ÂÏ× ïðîâîäÿò ó æåíùèí. Ìàòåðèàëîì äëÿ èññëåäîâàíèÿ ñëóæèò ñîñêîá öåðâèêàëüíîãî êàíàëà è/èëè çîíû òðàíñôîðìàöèè, âûïîëíåííûé öåðâèêàëüíîé öèòîëîãè÷åñêîé ùåòî÷êîé. Èññëåäîâàíèå âàãèíàëüíîãî ñîäåðæèìîãî èëè ñîñêîáà óðåòðû ìåíåå èíôîðìàòèâíî, ÷åì èññëåäîâàíèÿ öåðâèêàëüíûõ ñîñêîáîâ.
Èññëåäîâàíèÿ íà ÂÏ× ó ìóæ÷èí. Èíôèöèðîâàííîñòü ìóæ÷èí ÂÏ× ñõîäíà ñ èíôèöèðîâàííîñòüþ æåíùèí, íî ââèäó àíàòîìè÷åñêèõ îñîáåííîñòåé ìóæñêîãî óðîãåíèòàëüíîãî òðàêòà (îòñóòñòâèå «çîíû òðàíñôîðìàöèè» ýïèòåëèÿ) ìóæ÷èíû, â áîëüøèíñòâå ñëó÷àåâ, ñàìîñòîÿòåëüíî èçëå÷èâàþòñÿ èëè ÿâëÿþòñÿ áåññèìïòîìíûìè íîñèòåëÿìè èíôåêöèè. Ñ ó÷åòîì òîãî, ÷òî îïàñíîñòü ðàçâèòèÿ îíêîëîãè÷åñêîé ïàòîëîãèè ó ìóæ÷èí íå âåëèêà, à èíôèöèðîâàíèå ïàðòíåðøè íå îçíà÷àåò ðàçâèòèå êëèíè÷åñêèõ ïðîÿâëåíèé èíôåêöèè (ò. ê. âûñîêà âåðîÿòíîñòü ñàìîñòîÿòåëüíîãî èçëå÷åíèÿ èíôåêöèè (îêîëî 80%)), ïðîâîäèòü ñêðèíèíã ïàïèëëîìàâèðóñíîé èíôåêöèè ó ìóæ÷èí íå ðåêîìåíäóåòñÿ. Èññëåäîâàíèå ïðîâîäÿò ëèøü ïî ýïèäåìè÷åñêèì ïîêàçàíèÿì èëè äëÿ äèôôåðåíöèàëüíîé äèàãíîñòèêè.
Ñëåäóåò ïîìíèòü, ÷òî íàëè÷èå ÂÏ× ó îäíîãî èç ïàðòíåðîâ ïðè îòñóòñòâèè ÂÏ× ó äðóãîãî èëè íåñîâïàäåíèå ó ïàðòíåðîâ ñïåêòðà ãåíîòèïîâ ÿâëÿþòñÿ íîðìàëüíûì îòðàæåíèåì áèîëîãèè âèðóñà è íå ìîãóò ãîâîðèòü î ñóïðóæåñêîé íåâåðíîñòè (îáû÷íî ó îäíîãî èç ïàðòíåðîâ ïðîèñõîäèò áîëåå áûñòðàÿ ýëèìèíàöèÿ âèðóñà, ïðè èíôèöèðîâàíèè ïàðû íåñêîëüêèìè ãåíîòèïàìè ó ïàðòíåðîâ ìîæåò ïðîèñõîäèòü ýëèìèíàöèÿ ðàçíûõ òèïîâ, ïðè ýòîì ïîñëå ñàìîñòîÿòåëüíîãî èçëå÷åíèÿ îò ÂÏ× îïðåäåëåííîãî ãåíîòèïà ðåèíôèöèðîâàíèÿ íå ïðîèñõîäèò).
Ìîëåêóëÿðíûå ìåòîäû äèàãíîñòèêè
ÏÖÐ. ÂÏ×, êà÷åñòâåííîå îïðåäåëåíèå
Источник