Мутации генов при меланоме
- Частота и виды мутаций в гене BRAF
- Cтатус мутации гена BRAF и выбор тактики лечения
Частота и виды мутаций в гене BRAF
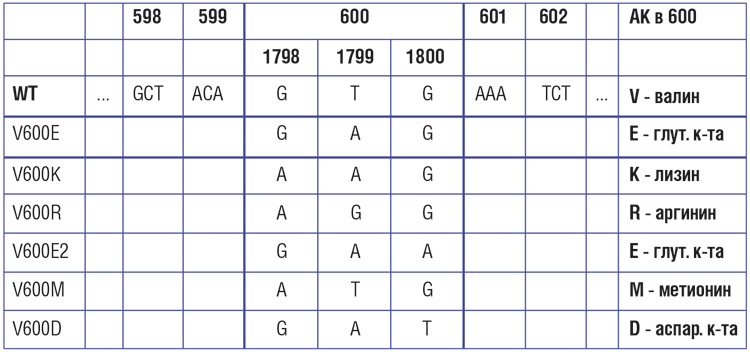
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.
Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
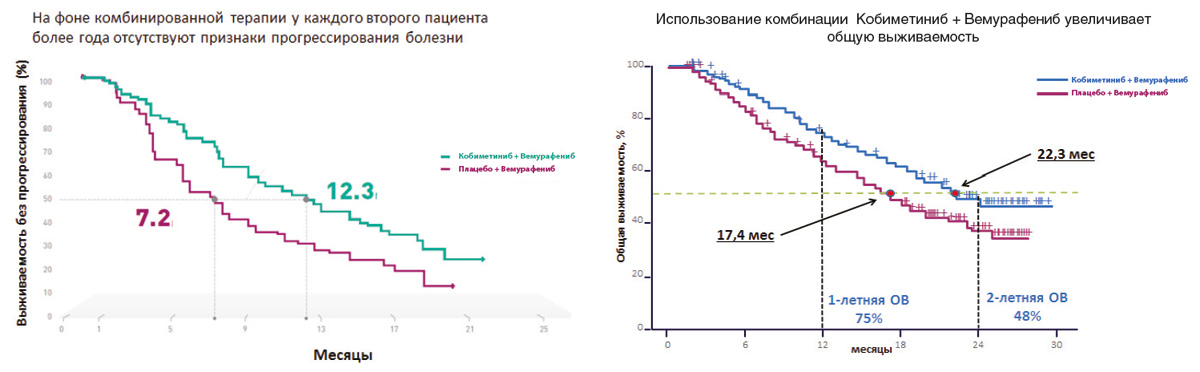
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
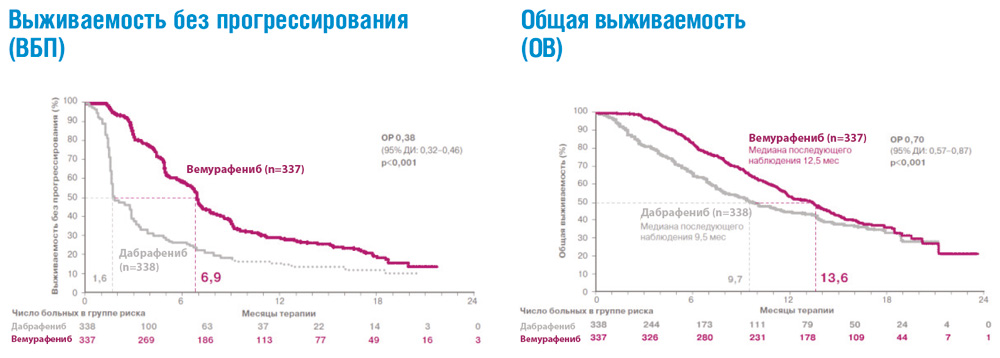
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.

Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
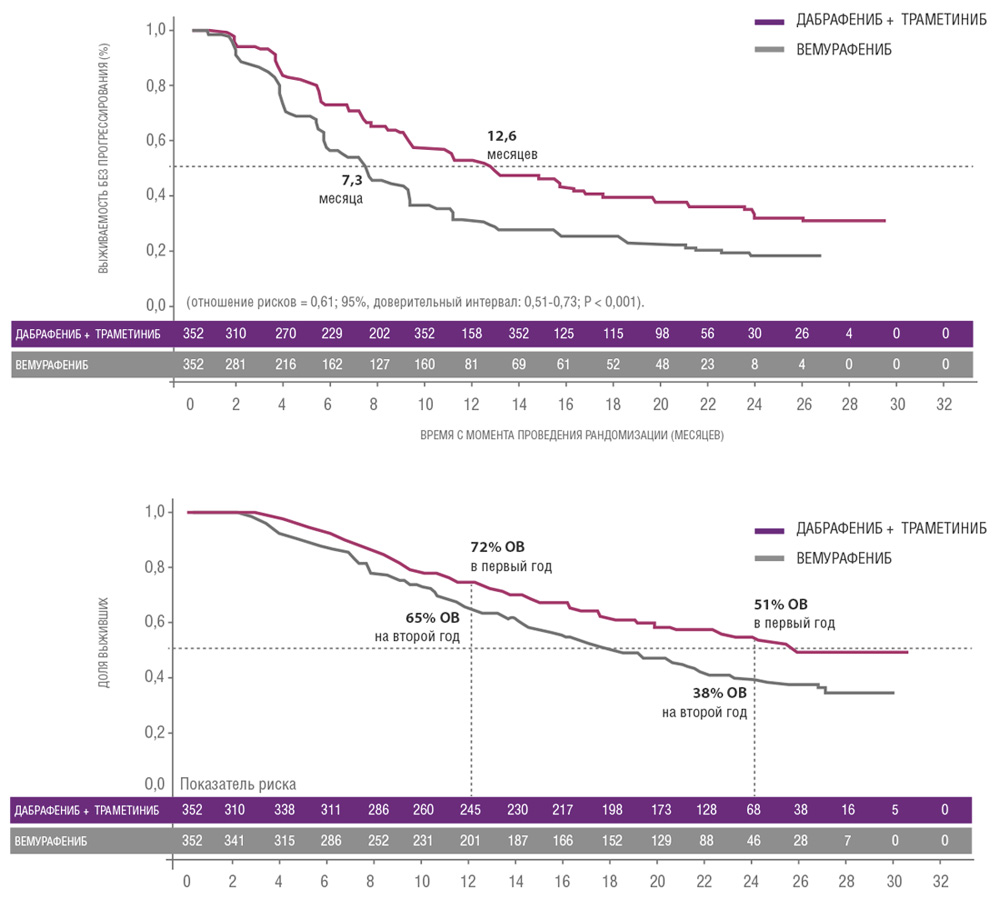
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
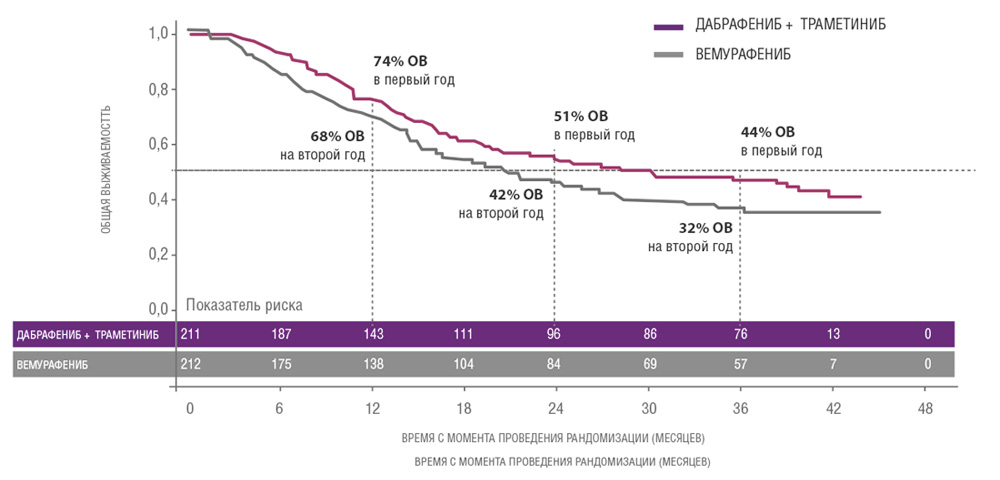
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Статьи:
- Г.Ю. Харкевич. Вемурафениб в лечении метастазов меланомы в головной мозг. Онкология. Журнал им. П.А. Герцена, 6, 2014.
- Г.А. Франк et al, Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив Патологии, 3, 2014.
- С.А. Проценко et al, Современные возможности персонализированной терапии метастатической меланомы кожи. Современная онкология №3, том 16, 2014.
- Larkin J et al. Update of progression-free survival and correlative biomarker analysis from coBRIM: Phase 3 study of cobimetinib plus vemurafenib in advanced-BRAFmutated melanoma; Poster presentation at ASCO 2015.
- Robert C, et al. Ann Oncol. 2015; 26 (suppl 6) [abstract 3301].
- Flaherty K, et al. J Clin Oncol. 2016; 34 (suppl; abstr 9502).
- Hauschild A, et al. Poster presented at ESMO 2014, Abstract 1092PD.
- Robert, C. LBA4 Oral presentation at ESMO 2015.
Источник

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
По данным разных авторов, BRAF мутация встречается от 30% до 70% пациентов, которым поставлен диагноз «меланома». При этом изменения в гене могут быть самыми разнообразными. Всего известно более 40 BRAF мутаций, но наиболее часто (около 90% всех случаев) выявляется замена аминокислоты валина на аминокислоту глутамина в кодоне 600. Соответственно, такая мутация называется BRAF V600E. Второе по популярности изменение в гене при меланоме – это замена аминокислоты валина на аминокислоту аспарагин в том же кодоне. Такая мутация обозначается V600K.
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Запись
на консультацию
круглосуточно
Источник
Рак кожи, более известный как меланома, являющаяся злокачественным новообразованием, протекает крайне быстро. При меланоме довольно часто возникают рецидивы, а метастазы проникают практически во все органы. Чтобы препятствовать скоротечному развитию данного заболевания просто необходимо раннее диагностирование, профессиональная и своевременная терапия в медицинских учреждениях, которые специализируются на лечении онкологии.
Меланома довольно часто мутирует. И поэтому в нашем лечебном учреждении в практику обязательного обследования входит и анализ на различные мутации меланомы. Определить наличие подобных мутаций и, непосредственно, их видов крайне важно. Во-первых, данный анализ позволяет оценить механизм развития злокачественных процессов в клетке. А, во-вторых, благодаря анализу подбираются те препараты, которые будут оказывать наиболее эффективное действие при лечении меланомы с определённым видом мутации. Происходит, так называемая, таргентная терапия.
Наиболее часто встречающихся мутаций меланомы три:
- BRAF;
- c-Kit;
- NRAS;
Мутация BRAF
Этот вид мутации меланомы встречается чаще всего. Его выявляют примерно у 40-70% больных меланомой. Мутация BRAF имеет такое название в связи с тем, что именно ген BRAF, являющийся ответственным за один из сигнальных путей в клетках, когда происходит мутация, вырабатывает особый белок. Именно этот белок выступает своеобразным провокатором, из-за которого начинается рост клеток и появление новообразований. Необходимо сказать, что в нормальном состоянии путь, за который отвечает ген BRAF, является неактивным. Мутация BRAF, таким образом, выявленная в меланоме, имеет название – BRAF-позитивная. Выявить мутацию очень важно, так как она может положительно повлиять на прогноз лечения меланомы. Для BRAF-позитивной мутации разработаны особые препараты. Они выступают в качестве блокираторов мутирующего гена. Шансы на благоприятный исход очень сильно зависят от ранней диагностики и точности определения степени мутации.
Мутация c-Kit
Этот вид мутации встречается не так часто, как мутация BRAF. Его выявляют у 6-15% больных. Kit-мутации, как правило, выявляются в меланомах, которые находятся на слизистых половых органов, прямой кишки, носоглотки и носовых ходов. Выявляется мутация c-Kit и в меланомах, которые расположены на ногтях и ладонях. Кстати, меланома c-Kit может проявляться в сочетании с мутацией BRAF. При выявлении данного вида мутации назначают для лечения препараты-ингибиторы c-Kit. В 30% случаев терапия имеет положительный эффект.
Мутация NRAS
Данный вид мутации выявляется в 15-20% случаев. Данный вид мутации может выступать в сочетании с другими видами мутаций крайне редко. Также как и в случае с геном BRAF, NRAS вырабатывает белок, который является активатором злокачественного роста клетки. Самое главное, что стоит предпринять при выявлении данного вида мутации, это заняться блокировкой вырабатывания протеин-киназы. Препараты, которые следует применять при лечении мутации NRAS, всё ещё проходят клинические исследования. Однако даже на этой стадии положительный результат обнаруживается у 20% больных, которые подвергаются терапии данными препаратами. Выявлено, что процесс развития опухоли при лечении замедляется.
Наша клиника предлагает пациентам:
- Различные методы раннего диагностирования болезни. Мы также проводим и диагностические операции. У нас есть всё необходимое оборудование и лучшие препараты.
- Операбельное лечение, с использованием самых новых и щадящих методов.
- Иммунотерапию.
- Таргентную терапию, с применением самых современных лекарств.
- Наблюдение у узкоспециализированных врачей – дерматоонкологов, которые имеют большой опыт именно в лечении рака кожи (меланомы).
- Лечение больных даже на самых поздних стадиях заболевания.
Источник
В последнее время достигнуты значительные успехи в понимании патогенеза меланомы.
Меланома отличается генетической нестабильностью и повышенным уровнем соматических мутаций по сравнению с другими солидными опухолями.
При полногеномном секвенировании соматические мутации выявлены в 86% образцов меланомы в 43 из 46 генов, ассоциированных с канцерогенезом.
Гены в патогенезе меланомы
Основная роль в патогенезе меланомы принадлежит MAPK (mitogen-activated protein kinase) сигнальному пути – ключевому регулятору клеточной пролиферации, дифференцировки, выживания, подвижности и ангиогенеза. МAPK сигнальный путь участвует в передаче сигнала от различных внешних стимулов (ростовые факторы, цитокины, гормоны и стрессы) к внутриклеточным белкам через серию событий, включающих фосфорилирование и белок -белковое взаимодействие.
Гиперактивация MAPK-сигнального пути наблюдается в 90% случаев меланомы и это достигается за счет активации различных участков каскада RAS-RAF-MEK-ERK. Регуляция MAP киназного пути происходит различным образом. Усиление сигналинга ERK происходит в результате активирующих мутаций или амплификации генов, кодирующих компоненты RAS-RAF-MEK-ERK пути. В меланоме кожи наиболее часто определяются точечные мутации в генах BRAF (50-70%) или NRAS (15-30%). Молекулярная классификация учитывает локализацию первичного узла (очага) меланомы, генетические изменения в опухоли и экспозицию ультрафиолетовому облучению.
Ген BRAF кодирует серинтреониновую киназу BRAF, мутации в активирующем домене которой, вызывают каскадную активацию протеинкиназ MEK и ERK. Серин-треониновые киназы MEK1 и MEK2 катализируют фосфорилирование по треонину и тирозину белков ERK1 и ERK2, которые имеют много цитоплазматических и ядерных субстратов. Активация последних вызывает усиление клеточной пролиферации, дифференцировки, выживания, подвижности и ангиогенеза.
В 80% случаев меланомы с мутацией гена BRAF выявляется нуклеотидная замена T1799A, приводящая к замене валина на глутаминовую кислоту в кодоне 600 (V600E). В 20% случаев встречается замена V600K, редко – замены V600R/D/M. Мутации в киназном домене приводят к конформационным изменениям и повышению активности BRAF киназы в 70-130 раз in vivo. При других мутациях в 14 или 15 экзонах (кодоны L597, K601) активность BRAF киназы составляет лишь 30% от активности фермента с мутацией V600E.
Для лечения BRAF-положительной меланомы кожи одобрены для клинического применения и зарегистрированы препараты: вемурафениб (2011 г.), блокирующий димеризацию протеинкиназы BRAF с мутацией V600E и дабрафениб (2013 г.), который ингибирует BRAF с мутацией V600E/K, блокируя АТФ-связывающий сайт киназного домена, а также ингибиторы нижележащей киназы МЕК – траметининиб и кобиметиниб.
Вторым наиболее часто мутирующим геном в меланоме является ген NRAS. Белок NRAS относится к семейству малых ГТФ-связывающих белков и, в отличие от BRAF, активирует не только каскад RAF-MEK-ERK, но и другие сигнальные пути: Ral-GDS, PI3K-AKT-mTOR и PLC-PKC.
Мутации NRAS выявлены в 15-18% меланомы кожи. Большинство (80%) мутаций затрагивают кодон Q61 в 3 экзоне NRAS: нуклеотидная замена C436A приводит к замене глутамина на лизин (Q61K), а мутация A437G – к замене глутамина на аргинин (Q61R). Реже возникают мутации во 2 экзоне NRAS в кодонах G12, G13.
Часто в образцах меланомы, содержащих гены BRAF и NRAS дикого типа, амплифицированы гены CDK4 и OGND1 (циклина D1), кодирующие нижележащие субстраты ERK. Ген CDK4 кодирует цик-лин зависимую киназу CDK4, входящую в комплекс CDK4/6. Нарушения гена CDK4, как и гена CDKN2A, встречаются в соматических меланомах, а герминальные мутации ассоциированы с риском развития семейной меланомы кожи. Наследственные активирующие мутации гена CDK4 делают комплекс CDK4/6 устойчивым к ингибированию p16INK4a.
В 20-40% случаев семейной меланомы найдены мутации генасупрессора CDKN2A, кодирующего белки p14ARFH p16INK4a. Помимо наследственных мутаций в 50% образцов меланомы встречаются соматические мутации и эпигенетические изменения p16INK4a. Низкая экспрессия p16INK4a коррелирует с прогрессией заболевания, усилением пролиферации и плохим прогнозом при спорадической меланоме.
Инактивация p16INK4a приводит к активации cyclin D/CDK4 и фосфорилированию pRB1, что ведет к активации клеточного цикла и пролиферации клеток. Мутации p14ARF приводят к недостатку белка p53, который контролирует целостность и репарацию ДНК. Мутации гена TP53 встречаются в 16% случаев меланомы кожи, часто в опухолях с мутациями BRAF или NRAS.
Для развития меланомы важным событием является активация сигнального пути PI3K-AKT-mTOR, причем, уровень активности AKT3 повышается с увеличением стадийности меланомы. Активация серин-треониновой киназы AKT3 отмечена в 60% случаев спорадической меланомы: в 35% случаев за счет амплификации гена AKT3, а в 5% – за счет мутации гена PI3KGA.
В 40-60% меланомы наблюдается инактивация фосфатазы PTEN, которая негативно регулирует PI3K-AKT сигналинг. Подавление экспрессии PTEN происходит в результате мутации кодирующего гена, потери гетерозиготности или утраты хромосомного локуса, либо в результате эпигенетических нарушений транскрипции гена за счет метилирования или микро-РНК регуляции.
Активация PI3K-AKT пути важна для прогрессирования невуса в меланому. Усиленная экспрессия онкогенных белков NRAS или BRAF недостаточна для трансформации нормальных меланоцитов. В процессе развития меланомы имеет место кооперация амплификации гена AKT3 и мутации BRAF.
Мутации генов и меланома кожи
Другие пути, регуляция которых нарушена при меланоме, включают ген KIT. Этот ген кодирует тирозинкиназный рецептор KIT фактора роста стволовых клеток (SCF), который играет ключевую роль в эмбриогенезе меланоцитов, их дифференцировке и пролиферации. В результате взаимодействия с лигандом SCF, рецептор KIT активирует ряд сигнальных путей (RAS-MAPK, PI3K-AKT, SRK и другие), усиливая клеточный рост, пролиферацию, инвазию, метастазирование и ингибируя апоптоз.
Мутации гена KIT встречаются в 2-6% меланомы кожи. Рецептор KIT экспрессируется на ранних стадиях меланомы более, чем в 50% случаев, однако по мере прогрессирования и перехода меланомы в инвазивные стадии, экспрессия KIT утрачивается, что предполагает супрессорные функции KIT. Действительно, трансфекция гена KIT в высоко метастатическую линию клеток меланомы A375SM ведет к уменьшению роста опухоли и метастазов при последующем введении этих клеток мышам.
Введение фактора роста стволовых клеток SCF – лиганда рецептора KIT, приводит к высокому уровню апоптоза в KIT-позитивной линии клеток меланомы. Потеря экспрессии KIT коррелирует со злокачественной трансформацией меланоцитов, инвазией и метастазированием опухоли. В небольшом проценте случаев меланомы кожи с диким типом BRAF и NRAS выявлены опухоли с гиперэкспрессией KIT и CDK4.
Мутации KIT не встречаются одновременно с мутациями NRAS или BRAF. Мутации KIT чаще всего представлены точечными заменами в экзоне 11, кодирующем регуляторный JM-домен рецептора, и реже заменами в экзонах 9, 13, 17 и 18. Тирозинкиназный ингибитор иматиниба мезилат эффективен при лечении меланомы кожи, если мутантный белок KIT к нему чувствителен, обычно вследствие мутаций в экзонах 11 или 13 кодирующего гена.
Случаи меланомы с мутациями BRAF и NRAS отличаются по клинико-морфологическим характеристикам и клиническому поведению.
Опухоли с мутациями NRAS чаще имеют больший размер и более высокий митотический индекс. Такие меланомы отличаются большей толщиной, чем опухоли с диким типом гена или мутацией BRAF и, по-видимому, связаны с вертикальной фазой роста меланомы. Трансфекция гена RAS в клеточные линии меланомы с эпителиоидно клеточной морфологией усиливает продукцию протеазы и клеточную подвижность, черты, характерные для фазы вертикального роста меланомы.
Наличие мутаций BRAF ассоциировано с более частым изъязвлением опухоли, с более частым развитием местных рецидивов и поражением регионарных лимфатических узлов, частота мутаций BRAF выше у пациентов с выживаемостью менее 5 лет. Мутации BRAF ассоциированы с более ранним временем постановки диагноза, чем NRAS. Пациенты с меланомой и мутациями BRAF значительно моложе (49,8 лет), чем с мутациями NRAS (55,7 лет), или диким типом этих генов (59,5 лет) и это отличие статистически достоверно.
Мутации NRAS чаще присутствуют в меланоме кожи, связанной с хроническим солнечным повреждением. Также мутации NRAS выявляют в 94,7% случаев врожденных меланоцитарных новообразований, которые характеризуются повышенным риском трансформации в меланому. Показано, что мутации NRAS связаны с низкой общей выживаемостью и являются независимым признаком более короткого выживания у пациентов с меланомой IV стадии.
Нами проведен анализ мутаций генов BRAF и NRAS в 19 культурах клеток меланомы. Мутация BRAF обнаружена в 13 клеточных линиях: в 10 выявлена замена V600E, в двух V600K и в одной -L597Q (табл. 4.1).
Таблица 4.1. Мутации BRAF и NRAS в клеточных линиях меланомы

Среди культур клеток меланомы с мутацией BRAF V600E/K большинство клеточных линий было низко (6) или умеренно (6) дифференцированны. Одна линия высокодифференцированных клеток меланомы (mel Si) содержала мутацию BRAF L597Q. Мутация NRAS Q61K выявлена в 4 линиях клеток меланомы, из которых 3 культуры были низко дифференцированных и одна – высоко дифференцированных клеток. В одной культуре низко дифференцированных клеток меланомы выявлена мутация NRAS Q61R. В культуре mel Ksen умеренно дифференцированных клеток мутации BRAF и NRAS не обнаружены.
И.Н. Михайлова, М.М. Давыдов
Опубликовал Константин Моканов
Источник