Этиология и патогенез меланомы кожи
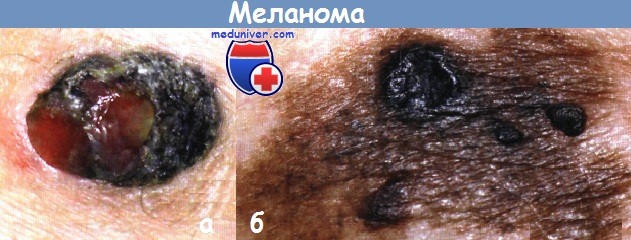
Этиология и патогенез меланомы1. Инсоляция как причина развития меланомы. Одним из основных пусковых механизмов развития меланомы является увеличение суммарного времени воздействия УФО на кожу человека, не всегда генетически к этому подготовленную. Избыточная инсоляция приводит не только к повреждению кератиноцитов и меланоцитов, но и вызывает специфическую иммуносупрессию, связанную с нарушением функции естественных киллеров, что сопровождается повышенным риском развития неходжкинских лимфом и опухолей кожи, включая меланому. Избыточная инсоляция особенно вредна в детском возрасте. Шванновские клетки и дендриты, контактирующие с меланоцитами, в условиях УФО проникают в базальный слой эпидермиса. К провоцирующим факторам, вызывающим меланому кожи, относятся также три и более эпизода тяжелых солнечных ожогов кожи в течение жизни . 2. Фенотипические характеристики кожи. Такие фенотипические признаки, как светлая пигментация кожи, русые или рыжие волосы, голубые или зеленые глаза, выраженная склонность к появлению веснушек и развитию солнечных ожогов (I—II фототип кожи) могут предрасполагать к возникновению меланомы.
3. Доброкачественные меланоцитарные новообразования. В 30—50% случаев меланомы развиваются из предшествующего доброкачественного пигментного образования. Кроме того, к факторам риска относится наличие у пациентов более 50 меланоцитарных невусов диаметром > 2 мм, а также трех и более диспластических невусов. В настоящее время считается, что только 20% меланом имеют гистологические доказательства трансформации из меланоцитарных невусов (в 43% случаев — из диспластических, в 57% — из других видов невусов). Предложен еще один критерий, предполагающий повышенный риск развития меланомы: наличие более 10 родинок размером > 2 мм у пациентов в возрасте до 30 лет с локализацией в области лица. Кроме того, ранее считалось, что активация и малигнизация меланоцитарных невусов происходит в период полового созревания, беременности и климактерических перестроек. В настоящее время доказано, что гормональные изменения у беременных не стимулируют возникновение меланомы кожи. Однако, возможно, и существует гормональное влияние на развитие данной злокачественной опухоли, так как у кастрированных по каким-либо причинам мужчин или женщин меланомы не наблюдаются. Меланомы могут также развиваться на фоне врожденных невомеланоцитарных невусов, преимущественно гигантских, о чем подробно изложено в части III данного атласа. 4. Семейный анамнез как причина развития меланомы. Установлено, что пациенты с семейной меланомой составляют 10—15% от всех больных с меланомой. Меланома считается семейной, если помимо пациента она была диагностирована еще у родственников первой (родители, дети, братья, сестры) и/или второй (дедушки и бабушки и другие) степени родства. Случай меланомы у одного родственника первой степени родства удваивает риск развития этой опухоли. 5. Анамнез. Возникновение меланомы и интенсивность ее опухолевой атаки зависит от силы и продолжительности стресса (особенно в связи со смертью ближайших родственников). Наличие меланомы в анамнезе увеличивает риск повторной первичной меланомы, при этом возможно развитие множественных первичных меланом. Примерно у половины пациентов с множественными первичными меланомами вторая первичная меланома возникает в той же анатомической области, и примерно у половины больных вторая первичная меланома появляется в течение года после постановки первого диагноза. Повторные первичные меланомы могут развиваться через десятилетия после выявления первичной опухоли. 6. Генетические нарушения как причина развития меланомы. Мутации в некоторых генах (CDKN2A, BRAF и MC1R) могут провоцировать развитие меланомы. Мутации в гене опухолевого супрессора, ингибитора циклинзависимой киназы 2а (CDKN2A) встречаются в 40% случаев наследуемой меланомы. CDKN2A кодирует два генетических продукта: р16 (ингибитор киназы 4 а) и рl4ARF (альтернативная рамка считывания). Продукт р16 является регулятором клеточного цикла, связывающим и подавляющим циклинозависимые киназы CDK4 или CDK6, тем самым останавливая клеточный цикл в фазе G1. Если функция р16 отсутствует или инактивирована в результате мутации, неограниченная активность CDK4 приводит к фосфорилированию протеина ретинобластомы и, как следствие, к высвобождению фактора транскрипции E2-F и индукции S-фазы. Эта последовательность событий приводит к увеличению клеточной пролиферации, которая в отсутствие регуляции в контрольных точках приводит к неограниченному росту и новообразованию. Мутации гена серин/треониновая киназа (BRAF) выявляют в 66% случаев меланом. Мутации BRAF значительно чаще встречаются при меланомах, развивающихся у больных на участках кожи, подверженных эпизодическому воздействию солнечного света. Мутации в рецепторе меланокортина-1 (MC1R) повышают риск развития меланомы примерно в 2—4 раза в общей популяции. Эта мутация связана с формированием фенотипа с рыжими волосами и светлой кожей.
– Также рекомендуем “Гистологические типы меланом – морфология” Оглавление темы “Меланома”:
|
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Франциянц Е.М.
1
Позднякова В.В.
1
Максимова Н.А.
1
Курышова М.И.
1
Ильченко М.Г.
1
1 ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России
Заболеваемость и смертность пациентов с меланомой кожи характеризуется тенденцией к росту в настоящее время. Основными методами диагностики являются дерматоскопия, цитологическое исследование, эксцизионная биопсия, ультразвуковая диагностика. Однако, актуальным является разработка новых маркеров, создание наиболее совершенной диагностической системы, изучение результатов комплексного применения нескольких известных маркеров, что позволит расширить диагностические возможности специалистов в выявлении меланоцитарных образований кожи. В обзоре представлены сведения о патогенетической значимости ростовых факторов и компонентов системы активации плазминогена, маркеров Кi-67, р53, bcl-2, HMB-45, Melan PNL2 при росте, развитии и лечении меланомы кожи. Выявленные метаболические изменения указывают на тесную связь патогенеза меланомы кожи и невусов, а также на возможность малигнизации последних. Дальнейшие исследования факторов роста, компонентов системы активации плазминогена, маркеров пролиферации и апоптоза могут расширить возможности ранней диагностики меланоцитарных образований и будут способствовать оптимизации тактики лечения.
меланома кожи
невус
факторы роста
система активации плазминогена
иммуногистохимические маркеры
1. Боровская Т.Ф., Марочко А.Ю., Машенкина Я.А., Курпас Э.Х. Клинико-прогностическая значимость молекулярно-биологических маркеров супрессии опухолевого роста, пролиферации и их регуляторов при меланоме кожи.// Дальневост. Мед. Журнал. – 2010. – № 1. – С. 119-122.
2. Герштейн Е. С. Система активации плазминогена как показатель метастатической активности опухолей и потенциальная мишень противоопухолевой терапии // Материалы IV ежегодной Российской онкологической конференции. – М., 2000. – С. 21.
3. Герштейн Е. С., Кушлинский Н. Е. Активаторы плазминогенаурокиназного и тканевого типов и их ингибитор PAI-1 в опухолях человека // Бюлл. эксп. биол. мед. – 2001. – Т.131, № 1. – С. 81.
4. Михнин А.Е., Тарков С.А., Фролова О.С., Меланома кожи головы и шеи; современное состояние проблемы// Вопросы онкологии. – 2012. -№1 – С. 19-25.
5. Непомнящая Е.М, Гусарева М.А., Петров С.В. // Вопросы онкологии. – 2008. – Т. 54, №6. – С. 744-748.
6. Парсункова К.А., Михайлова И.Н., Евстегнеева И.В., Чкадуа Г.З., Петенко Н.Н., Караулов А.В., Барашникова А.Ю., Ворожцов Г.Н. Сравнительный анализ содержания S-100, CD44, TFG-, VEGF-A в сыворотке крови больных с диссеминированной меланомой на фоне вакцинотерапии // Молекулярная медицина. – 2010. – № 6. – С. 34-39.
7. Позднякова В.В. Неоадьювантная химиотерапия в комплексном лечении больных меланомой кожи 1-3стадий: Автореферат дисс. д.м.н. – Ростов-н/Д., 2006. – 48 с.
8. Соколов Д.В. Булычева И.В., Махсон А.И., Воронцов Г.Н., Кузьмин С.Г. Диспластический невус // Российский онкологический журнал. – 2009. – №5. – С. 44-46.
9. Состояние онкологической помощи населению России в 2013 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петрова – М.: ФГБУ «МНИОИ им. П.А. Герцена» МЗ России. – 2014. – 235 с.
10. Франциянц Е.М., Козлова Л.С., Комарова Е.Ф., Позднякова В.В., Погорелова Ю.А., Черярина Н.Д., Хохлова О.В. Тканевая система активации плазминогена при меланоме кожи // Современные проблемы науки и образования. – 2013. – №2. – С. 407.
11. Франциянц Е.М., Комарова Е.Ф., Бандовкина В.А., Позднякова В.В., Черярина Н.Д. Сравнительная оценка экспрессии факторов роста в пигментных новообразованиях кожи // Молекулярная медицина. – 2015. – №1. – С. 14-16.
12. Франциянц Е.М., Комарова Е.Ф., Позднякова В.В., Погорелова Ю.А., Черярина Н.Д., Розенко Л.Я., Хохлова О.В. Система факторов неоангиогенеза и пролиферации в ткани меланомы кожи, ее перифокальной зоны и по линии резекции // Фундаментальные исследования. – 2013. – №7 (ч. 2). – С. 423-427.
13. Франциянц Е.М., Комарова Е.Ф., Позднякова В.В., Розенко Л.Я., Погорелова Ю.А., Черярина Н.Д., Хохлова О.В. Показатели системы активации плазминогена и ростовых факторов в ткани невусов и меланомы кожи // Молекулярная биология. – 2014. – Т.48, № 3. – С. 518.
14. Besaratinia A., Pfeifer C.P. Measuring the formation and repair of UV damage at the DNA sequence level by ligation-mediated PCR // Methods Mol Biol. – 2012. 920:189-202.
15. Groves M.D., Hess K.R., Puduvalli V.K., Colman H., Conrad C.A., Gilbert M.R., Weinberg J., Cristofanilli M., Yung W.K., Liu T.J. Biomarkers of disease: cerebrospinal fluid vascular endothelial growth foctor (VEGF) and stromal cell derived factor (SDF)-1 levels in patients with neoplastic meningitis (NM) due to breast cancer, lung cancer and melanoma // J. Neurooncol. – 2009. – №94. – P. 229-234.
16. Mackie R.M., Hauschild A., Eggermant A.M. Epidemiology of invasive cutaneus melanoma // Ann Oncol. – 2009. – 20 Suppl 6.
17. Perera M., Tsang C.S., Distel R.J., Lacy J.N., Ohno-Machado L., Ricchiuti V., Samaranayake L.P., Smejkal G.D., Smith M.G., Trachtenberg A.J., Kuo W.P. TFG-1 interaotome: metastasis and bejond // CancerGenom. Proteom. – 2010. – №7 – P. 217-229.
18. Sachdev D., Yee D. Disrupting insulin-like growth factor signaling as a potential cancer therapy // Mol. Cancer Ther. – 2008. – №6. – P. 1-12.
19. Zhu X., Asa S.L., Ezzat S. Genetic and epigenetic mechanisms down-regulate FGF receptor 2 to induce melanoma-associated antigen A in brest cancer // Am. J. Pathol. – 2010. – №176. – P. 2333-2343.
Меланома кожи является уникальной опухолью, способной демонстрировать редкое многообразие клинического течения. Прогноз и исход заболевания у пациентов зависят от многочисленных факторов, характеризующих как первичную опухоль, так и организм больного. Распространенность (численность контингента больных на 100 тыс. населения) меланомой кожи среди злокачественных новообразований в России возросла с 32,7 в 2002году до 50,1 в 2012году. Несмотря на определенные успехи, достигнутые в последние годы в лечении меланомы кожи, результаты 5-летней выживаемости остаются невысокими, а доля летальности достигает 80% среди всех злокачественных новообразований кожи [9].
Среди этиопатогенетических факторов развития меланомы считают избыточное ультрафиолетовое облучение, которое обладает множеством механизмов деструктивного воздействия на кожу, одним из которых является прямое ДНК повреждение [14], канцерогенное химическое, термическое или радиоактивное воздействие на кожу, травматизация невусов. До 5% пациентов могут иметь наследственный характер меланомы кожи. Отмечена так же возможность постепенного перерождения невусов, пигментных пятен – лентиго [16].
Диагностика меланомы в ряде случаев сложна, несмотря на применение комплекса современных исследований – дерматоскопия, цитологическое исследование, эксцизионная биопсия, ультразвуковая диагностика [8, 4]. Ранние стадии поверхностно-распространяющейся формы меланомы кожи, а также лентиго-меланомы, узловые меланомы, имеющие фазу горизонтального роста способны маскироваться под меланоцитарный невус или другие доброкачественные образования кожи.
Прогноз и исход заболевания зависят от многочисленных факторов, характеризующих первичную опухоль. Патогенез меланомы – сложный процесс, сопровождающийся значительными метаболическими и молекулярными нарушениями [1], и следует признать, что многие вопросы остаются пока неясными, недостаточно изученными, представляют большой научный и практический интерес.
Изучение некоторых молекулярно-биологических параметров меланоцитарных образований кожи может способствовать раскрытию новых звеньев патогенеза меланомы и поиску дополнительных диагностических критериев. В этом аспекте интересным представляется сравнительное изучение метаболических изменений в ткани пигментных невусов (доброкачественных, пограничных) и меланом различной степени распространенности.
В эволюции опухоли одним из важнейших моментов является протеолиз. В активации ассоциированных с опухолью протеиназ играют большую роль активаторы плазминогена, а соотношение экспрессии различных компонентов системы активации плазминогена в опухолевой ткани служит показателем биологической агрессивности опухоли. Многочисленными исследованиями показано, что повышенный уровень урокиназного активатора и его ингибитора PAI-1 в опухолевой ткани при большинстве локализаций рака служит диагностическим и прогностическим фактором [2, 3].
В образцах ткани меланомы кожи больных и ткани пигментных невусов был проведен сравнительный анализ активности плазмина, плазминогена, содержания и активности активатора плазминогена урокиназного типа, активатора плазминогена тканевого типа, ингибитора активатора плазминогена [13]. Выявленные авторами изменения указывают на возможные механизмы злокачественной трансформации невусов кожи. Эти результаты могут оказаться полезными при разработке методов оценки степени риска неопластического перерождения невусов и методов профилактики.
Изучение системы активации плазминогена в зависимости от распространенности процесса [10] позволили авторам предположить, что компоненты системы активации плазминогена имеют патогенетическое значение для роста и развития меланомы кожи. При исследовании активности и содержания плазмина, плазминогена, uPA, tPA, PAI-1 установлено, что уровень показателей системы активации плазминогена в образцах меланомы кожи имел четкую зависимость от степени распространенности процесса. Так, содержание плазмина в ткани меланомы кожи при рТ1-2N0M0 не имело достоверных отличий от контрольных значений, а при рТ3-4N0-ХM0 превосходило их в 20,2 раза. Уровень плазминогена был снижен в ткани меланомы как при рТ1-2N0M0, так и при рТ3-4N0-ХM0 в 1,7 раза и 2,9 раза соответственно. Уровень антигена uPA в ткани меланомы кожи при рТ1-2N0M0 был в 4,6 раза, а активность uPA – в 8 раза выше, чем в интактной коже. В ткани опухоли при рТ3-4N0-ХM0 уровень антигена возрастал в 11,3 раза относительно контрольных величин, а активности – в 25 раз. Уровень tPA антигена увеличивался от рТ1-2N0M0 до рТ3-4N0-ХM0в 1,7 раза и 2,2 раза, а tPA активность – в 1,3 раза и 2,3 раз соответственно относительно показателей в интактной коже. Уровень PAI-1 антигена при всех стадиях меланомы кожи не имел достоверных отличий от контрольных значений, тогда как его активность была в 1,8 раза выше, чем в ткани интактной кожи при рТ1-2N0M0 и в 2,9 раза при рТ3-4N0-ХM0. Таким образом, было обнаружено, что при рТ1-2N0M0 на фоне сниженного содержания плазминогена и повышенного уровня uPA и tPA не отмечено повышение образования плазмина, что имеет место при рТ3-4N0-ХM0.
Особое внимание обращают показатели в перифокальной зоне опухоли, которые практически полностью повторяют значения в самой опухоли. Это свидетельствует, по мнению авторов, что меланома кожи не является локальным заболеванием, а в его патогенез вовлечены, по крайней мере, окружающие структуры и неадекватное хирургическое вмешательство в окружающее ее метаболически измененное опухолевое поле может способствовать возникновению как местных, так и отдаленных метастазов, что особенно важно для ранних стадий процесса.
Плазмин активирует латентные факторы роста фибробластов и некоторые изоформы VEGF. В современной литературе многочисленные публикации посвящены исследованию экспрессии факторов роста при меланоме кожи. Среди них – трасформирующий фактор роста (TGT-β) [6, 17], инсулиноподобный фактор роста-1 (IFR-1) [18], фактор роста фибробластов (FGF) [19], фактор роста сосудистого эндотелия (VEGF) [15].
В ткани невусов и меланом в сравнительном аспекте была изучена активность ростовых факторов [11]. Показано, что ткань невусов имеет особенности метаболизма, отличающие их как от ткани меланомы, так и от здоровой кожи. Так, уровень VEGF,EGF-R,TGF и IFR-2 в ткани невусов достоверно не отличается от такового в интактной коже, тогда как содержание EGF,FGF,IFR-1 – от показателей в ткани меланомы ранней стадии.
Найденные изменения уровня VEGF-R в ткани невусов не сопровождались повышенным содержанием VEGF, т.е. патологический сигнальный путь VEGF/ VEGF-R в доброкачественном образовании еще не сложился, хотя предпосылки к его формированию, очевидно, заложены. Показано увеличение уровня в ткани невусов EGF,но не EGFR-1, что, как и в случае VEGF- VEGF-R, свидетельствует о незавершенности формирования одного из метаболических каскадов, обеспечивающих в ткани неоплазмы процессы пролиферации, ангиогенеза, инвазии. Повышенный уровень FGF в ткани невусов, как и показатель IFR-1, можно рассматривать как патогенетический фактор возможной злокачественной трансформации.
Выявленные метаболические изменения указывают на тесную связь патогенеза меланомы кожи и невусов, а также на возможность малигнизации последних.
В работе Франциянц Е.М, и соавт [12] исследовали уровень ростовых факторов – VEGF-А, EGF, TGF, FGF, IFR-1, IFR-2 и рецепторов VEGF-R, EGF-R в ткани меланомы кожи, перифокальной зоны опухоли и линии резекции, полученных при оперативном иссечении опухоли (рТ1-4N0-1M0) у больных обоего пола, возрастом от 55 до 76 лет. Показана активация VEGF в ткани меланомы, уровень которого коррелирует с содержанием инсулиноподобных факторов роста и не зависит от размеров опухоли. При T1-2N0M0 экспрессируется фактор роста эндотелия сосудов и его рецептор, однако, в ткани перифокальной зоны отмечено возрастание уровня VEGF, но не его рецептора. Отмечено также повышение уровня IFR-1 и IFR-2 в ткани меланомы T1-2N0M0 и ее перифокальной зоны и активация EGF, TGF и FGF. Исследованием обнаружено сходство метаболического состояния ткани меланомы и соответствующей перифокальной зоны и по мере прогрессии опухоли усиление метаболической нестабильности окружающего опухоль региона.
Подтверждением значимости показателей пролиферативной и апоптотической активности Кi-67, р53, bcl-2, меланинклеточного маркера HMB-45, маркера Melan PNL2 в патогенезе меланомы служат исследования их в оценке эффективности различных видов неоадьювантой терапии меланомы кожи.
Так, в работе, посвященной неоадьюватной химиотерапии в комплексном лечении больных меланомой кожи 1-3стадий [7,5] иммуногистохимическое исследование выявило снижение факторов пролиферации – Кi-67, апоптоза – р53 и маркера меланомы – HMB-45, под действием неоадъювантной АГХТ по сравнению с нелеченными опухолями. Было обнаружено, что маркеры факторов пролиферации Ki-67 выявляются в виде отчетливого окрашивания в меланоцитах. В меланомах без лечения наблюдалась экспрессия этого маркера, составляющая 93,2%. Однако в меланомах после неоадъювантного лечения экспрессия была снижена и составила 74,7% в группе после АГХТ. Маркер р53 отчетливо выявлялся в ядрах опухолевых клеток на (++) или (+++), что свидетельствовало об освобождении из блокады механизмов индукции апоптоза. В меланомах после неоадъювантного лечения АГХТ было отмечено снижение экспрессии до 68,7%, тогда как в нелеченных меланомах наблюдалась экспрессия до 83,5%. После проведения неоадъювантной химиотерапии экспрессии с маркером bcl-2 не отмечалось. Под действием неоадъювантной химиотерапии определялось снижение экспрессии маркера меланомы HMB-45 до 75,5% по сравнению с нелеченными – 95,5%.
При применении неоадъювантной локальной аутоплазмохимиотерапией в меланомах сохранялась неравномерно или умеренно выраженная экспрессия маркера меланомы Melan PNL2, реакция с антителами факторов апоптоза p53, реакция с антителами bcl-2 отсутствовала, либо отмечалось слабо положительное окрашивание антигена. При реакции с антителами маркера фактора пролиферации Ki-67 выявлялась очень низкая пролиферативная активность меланоцитов.
Под действием неоадъювантной аутоплазмохимиотерапии в сочетании с лучевой терапией в мелономах кожи имеются явления блокады пролиферации (повреждения локализации белка Ki-67, активация апоптоза CD95 (АПО-1), при сохранении цитоспецифического меланоцитарного антигена Melan PNL2. Проведенное иммуногистохимическое исследование меланом кожи выявило снижение факторов пролиферации Ki-67, апоптоза – р53, bcl-2, и маркера меланомы – НМВ-45 под действием неоадъювантной паратуморальной аутоплазмохимиотерапии в комбинации с аутогемохимиотерапией и лучевой терапией.
Выводы. Несмотря на существующие в настоящее время средства первичной и уточняющей диагностики меланомы кожи, заболеваемость и смертность от этого заболевания увеличивается с каждым годом. В связи с этим, актуальным является выявление новых маркеров и изучение результатов комплексного применения нескольких известных маркеров для создания наиболее совершенной диагностической системы.
Представленный анализ литературы показывает, что факторы роста, компоненты системы активации плазминогена, маркеры пролиферации и апоптоза являются параметрами, играющими роль в патогенезе меланомы. Дальнейшие исследования факторов роста, компонентов системы активации плазминогена, маркеров пролиферации и апоптоза могут расширить возможности ранней диагностики меланоцитарных образований и будут способствовать оптимизации тактики лечения.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Библиографическая ссылка
Франциянц Е.М., Позднякова В.В., Максимова Н.А., Курышова М.И., Ильченко М.Г. НЕКОТОРЫЕ МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ АСПЕКТЫ ПАТОГЕНЕЗА МЕЛАНОМЫ КОЖИ // Современные проблемы науки и образования. – 2015. – № 1-2.;
URL: https://science-education.ru/ru/article/view?id=20062 (дата обращения: 18.11.2019).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


