Ассоциированный впч что это

Работаем вместе для вашего здоровья!
ЗАПИСЬ НА ПРИЁМ
Оставьте свои данные и наш администратор свяжется с Вами в ближайшее время
ЗАДАТЬ ВОПРОС ВРАЧУ
Задайте свой вопрос и специалист ответит Вам в ближайшее время
Регистрация на конференцию
Введите данные для регистрации на конференцию.
Отзывы и предложения
Оставьте свой отзыв или напишите предложение
Клиника ООО «АРС Медика плюс» г. Калининград
Черепанова М.А.
За последние 10-15 лет, уровень заболеваемости и смертности на фоне рака шейки матки значительно возрос и продолжает расти, поэтому так актуально знание алгоритмов диагностики и ведения женщин разного возраста с различной степенью поражения цервикального эпителия.
Комплексная профилактика и борьба с РШМ
Первичная:устранение факторов риска и вакцинация против ВПЧ (вируса папиломы человека).
Вторичная:цервикальный скрининг и лечение выявленных предраковых заболеваний ШМ (шейки матки).
Третичная: лечение РШМ (рака шейки матки) и паллиативная помощь.
- % популяции.
Клинические проявления ВПЧ-ассоциированных заболеваний шейки матки
Морфологическая классификация изменений цервикального эпителия (ВОЗ, Bethesdasystem, 2002г.)
То ,что вы можете увидеть в заключении цитологического мазка с шейки матки.
Стадии прогрессирования заболевания:
- инфицирование ВПЧ, койлоцитоз, или спустя месяцы — CIN I: плоскоклеточные и интраэпителиальные поражения низкой степени риска (ASCUS, LSIL);
- спустя годы — CIN II и CIN III: плоскоклеточные и интраэпителиальные поражения высокой степени риска (HSIL);
- спустя десятилетия — рак.Морфологическая классификация изменений цервикального эпителия (ВОЗ, Bethesdasystem, 2002г.)
I группая форма: бессимптомное вирусоносительство.
Субклинические формы:
- плоские кондиломы: типичная структура с множественными койлоцитами;
- малые формы: поражение метапластического эпителия с единичными койлоцитами (небольшая пунктуация и легкая мозаика);
- кондиломатозный цервицит/вагинит.
II группа
Клиническая форма
Интраэпителиальная неоплазия ШМ (LSIL, HSIL), вызванная онкогенными типами ВПЧ высокого риска и преинвазивный рак in situ.
При выборе метода цитологического исследования, предпочтение отдается жидкостному методу.
Преимущества жидкостной цитологии: улучшенное качество материала, длительный срок хранения биоматериала, можно приготовить несколько цитологических препаратов, приготовление стандартизированного монослойного мазка, стандартизированные методики окрашивания.
Диагностика ВПЧ:
мазок из цервикального канала на ВПЧ высокого онкогенного риска , скрининг 14 типов. ( причем типирование обязательно, потому что существую
Кольпоскопия
Желательно использовать этот метод как скрининг ежегодно .
Задачи: оценка состояния эпителия ШМ и влагалища, выявление очага поражения, дифференциация доброкачественных изменений от подозрительных, прицельная биопсия (в 25% случаев без контроля кольпоскопии не позволяет обнаружить интраэпителиальные поражения).
Тактика ведения ASCUS при ВПЧ+ у женщин 25+ лет
Нормальная кольпоскопическая картина → кольпоскопия + (ВПЧ + цитология) ежегодно.
Аномальная кольпоскопическая картина → биопсия и лечение.
Важно!! Необходимость лечения ИППП и восстановления микробиоценоза влагалища ( иследование микробиоценоза методом Фемофлор более информативно)
* У многих женщин с интраэпителиальными неоплазиями обнаруживается воспаление, которое способствует утяжелению процесса или маскирует имеющиеся изменения в сторону ложно+ или ложно- результатов.
* Выявлена взаимосвязь между тяжестью заболевания с распространенностью разнообразных микробиомов и низким уровнем lactobacillus spp.
* Роль других инфекций в развитии папилломавирусной инфекции
- Вызывают иммунодефицит, снижая противовирусную защиту.
- Способствуют персистенции ВПЧ в клетках эпителия.
ВПЧ и иммунитет
Течение ВПЧ-инфекции (персистенция и развитие до клинически значимых форм или регресс) зависит от активности иммунной системы.
* Согласно данным исследований, очень ограниченное количество лекарственных средств имеют доказанный эффект в отношении CIN и ВПЧ.
* Пациентки с CIN 3 и карциномой должны быть консультированы онкогинекологом .
* Папилломавирусная инфекция у беременных женщин (поражения ШМ)
- При наличии поражения ШМ LSIL у беременных женщин проводится кольпоскопия (предпочтительно, но допустимо отсрочить до 6 недель и провести после родов).
2. При отсутствии LSIL по данным кольпоскопии — обследование после родов.
3. При наличии LSIL — ведение согласно клиническим рекомендациям.
Источник

Вирус папилломы человека (ВПЧ) является серьезной причиной заболеваемости и смертности во всем мире. На сегодняшний день это один из самых распространенных вирусов, передающихся половым путем. Угрозе заражения вирусом подвержена значительная часть населения различных возрастов.
Каждый десятый человек на планете инфицирован этим вирусом.
Некоторые виды заболеваний, связанные с ВПЧ негативно сказываются на репродуктивной функции женщин. В России отмечается массовое выявление новых случаев онкологии женской репродуктивной системы, связанных с папилломавирусной инфекцией.
Из истории.

Поражения кожи и слизистых известны человечеству уже более тысячелетия. Под названием «кондиломы» они были описаны врачами Древней Греции. Особую актуальность инфекция приобрела в конце ХХ века. Вирусная природа бородавок была доказана в начале прошлого века, о половом пути передачи инфекции сообщили в 1954 г.
Частота кондиломатоза среди лиц молодого и среднего возраста:
– 1981-1986 гг. – 5,4%
– 1987-1999 гг. – 19,1%
– настоящее время – до 60%.
Что такое папилломавирусная инфекция?
Папилломавирусная инфекция – хроническое вирусное заболевание, передающееся от человека человеку половым путем.

Возбудитель инфекции.
Возбудитель заболевания -вирус папилломы человека (ВПЧ) -общее название для более 80 видов вирусов, провоцирующих различные заболевания кожи и слизистых оболочек организма. Каждый из вирусов группы ВПЧ имеет свой порядковый номер.
Вирус папилломы человека обнаруживается:
- на коже
- слизистых оболочках полости рта
- слизистых конъюнктивы
- слизистой оболочке пищевода
- слизистой бронхов, гортани
- слизистой прямой кишки
- слизистой половых органов
Передача вируса.
Передача вируса происходит только от человека к человеку.
Основной путь передачи – половой.
Возможны также:
– контактно-бытовой путь передачи инфекции при наличии микроповреждений эпителия – вирус может проникнуть в организм человека через царапины и ссадины, вирус от зараженного человека остается в бане, спортивном зале, бассейне, на полотенце, бритве
– медицинский персонал может инфицироваться вдыхая пыль во время удаления лазером генитальных бородавок, инфицироваться через хирургический инструментарий
– передача ребенку от матери во время беременности
Факторы, способствующие появлению или рецидивированию ВПЧ:
- Переохлаждение
- Гормональные нарушения
- Медицинские манипуляции (аборт, введение внутриматочной спирали)
- Беременность
Группы папилломавирусных инфекций:
- неонкогенные папилломавирусы (бородавки на кожных покровах)
- папилломавирусы низкого онкогенного риска (различные виды кондилом на половых органах)
- высокого онкогенного риска (опухолевые заболевания у женщин и мужчин)
Распространенность ВПЧ-ассоциированных заболеваний в мире

Инкубационный период папилломавирусной инфекции может длиться от 2 месяцев до 2-10 лет, в среднем – 3 месяца.
Для ПВИ характерно скрытое течение.
Клиническая картина.
Течение инфекции разнообразно. Она может спонтанно исчезать, затем снова прогрессировать.
Выделяют 3 формы течения заболевания:
- клиническая – наличие видимых папиллом
- субклиническая – отсутствие видимых проявлений, бессимптомное течение, выявляется только при дополнительном обследовании (кольпоскопия или исследование клеток)
- латентная – определяется только по анализу крови
Главные симптомы папилломавирусной инфекции – это появление:
- бородавок;
- папиллом – мягких наростов, которые крепятся к коже, благодаря ножке;
- остроконечных кондилом – наростов с шершавой поверхностью (в основном появляются вокруг заднего прохода и на половых органах).
Именно на эти симптомы необходимо обратить внимание в первую очередь.
Последствия заражения вирусом папилломы человека:
· Рак шейки матки находится на втором месте в списке причин смертности женщин. продолжительность жизни заболевших женщин снижается, в среднем, на 26 лет. Ежедневно 20 россиянок умирает от рака шейки матки. Доказано, что 70% случаев рака шейки матки вызвано ВПЧ 16 и 18 типов.
Рак шейки матки – полностью предотвратимое заболевание, если оно выявлено на ранней стадии рака или на стадии предрака.
· Рак вульвы и влагалища.
- Анальный рак. Ежегодно регистрируется около 100000 случаев этого вида рака.
- Рак полового члена. Вызывается в 35% случаев ВПЧ 16 и 18, ВПЧ 6 и 11-5% случаев.
- Аногенитальные бородавки. Вызываются ВПЧ 6 и 11. По данным ВОЗ, ежегодно в мире регистрируется более 30 млн случаев аногенитальных бородавок.
- Рак орофарингеальной области у молодых мужчин.
Как определить наличие вируса в организме и его тип?

В большинстве случаев инфекция протекает бессимптомно, поэтому вирус у пациента обычно выявляется только с помощью специального анализа.
Диагностика ВПЧ может включать:
- клинический осмотр пациента;
- обследование шейки матки;
- Полимеразная цепная реакция (ПЦР) – эффективный метод диагностики, благодаря которому можно определить тип вируса;
- цитологическое исследование – под микроскопом изучается характер клеток (мазок на цитологию из шейки матки);
- анализ крови для определения антител к ВПЧ (такой метод используется очень редко);
- биопсию – во время диагностической процедуры из «подозрительного места» (например, из кондилом или папиллом) берут частицы ткани. Назначается, если есть подозрение, что у пациента онкологическое заболевание.
Что такое пап-тест?

Это тест, с помощью которого можно определить предраковые или раковые клетки во влагалище и шейке матки. С поверхности шейки матки или канала специальным шпателем берется мазок. Взятый материал наносят на стекло и отправляют в лабораторию, где врачи-лаборанты тщательно изучают клеточное строение.
Тест назван именем греческого учёного Георгиоса Папаниколау.
Когда и кому необходимо проводить Пап-тест?
- Цитологический мазок нужно проводить каждой женщине не реже одного раза в год начиная с 18-летнего возраста или начала половой жизни. В случае отсутствия половых контактов, проведение анализа допустимо 1 раз в течение 3 лет.
- Два раза в год цитологический мазок рекомендуется проводить при использовании гормональной контрацепции, а также женщинам, которые страдают генитальным герпесом.
- Поводом для более частых цитологических исследований являются частая смена женщиной половых партнеров, избыточный вес (ожирение), бесплодие, наличие остроконечных кондилом половых органов.
Профилактика папилломавирусной инфекции.
Учитывая особую опасность данной инфекции, недостаточную эффективность существующих методов лечения, первоочередное значение приобретает профилактика данного инфекционного заболевания.
Неспецифическая профилактика:
- половое воспитание подростков
- ограничение числа половых партнеров
- использование презерватива снижает риск передачи ВПЧ
- цервикальный скрининг, представляющий собой регулярное обследование женщин с помощью Пап-теста (мазков с шейки матки) для своевременного выявления и лечения предраковой патологии
- отказ от курения
Специфическая профилактика:
 Вакцинация против наиболее опасных (онкогенных) типов ВПЧ мальчиков и девочек в возрасте 12-13 лет до начала половой жизни и потенциального контакта с ВПЧ. После вакцинации формируется стойкий иммунитет.
Вакцинация против наиболее опасных (онкогенных) типов ВПЧ мальчиков и девочек в возрасте 12-13 лет до начала половой жизни и потенциального контакта с ВПЧ. После вакцинации формируется стойкий иммунитет.
Почему так необходима вакцина от папилломавирусной инфекции?
Вирусы папилломы человека вызывают злокачественное перерождение клеток, то есть являются причиной раковых заболеваний, в особенности рака шейки матки.
В последние годы имеет место стремительный рост частоты генитальных раковых заболеваний у мужчин, в связи с чем все чаще ставится вопрос о введении вакцинации от ВПЧ представителей обоих полов.
В настоящее время вакцинация против ВПЧ включена в календарь прививок в 57 странах мира, в шести из них введена вакцинация обоих полов.
Эффективность вакцинации достигает 98-100%, что было доказано клиническими исследованиями.
Вакцинация против ВПЧ проводится в России в рамках региональных программ иммунизации в Московской области, Ханты-Мансийском округе, Смоленской области, Челябинске и Санкт-Петербурге. Всего в стране реализовано порядка 30 подобных программ в разных регионах.
В Санкт-Петербурге за период с 2012 по 2015 год за счет бюджета города трехкратно уже привиты 22 548 девочек в возрасте 9-14 лет.
Вакцинация от ВПЧ наиболее эффективна до начала половой жизни, но рекомендуется всем женщинам молодого возраста.
В мире существует 2 основных вакцины – «Гардасил» и «Церварикс».
Внедрение масштабной вакцинации позволит предотвратить до 80-82% всех опухолей данной группы.
Профилактика папилломавирусной инфекции является одним из важнейших компонентов предупреждения рака шейки матки у женщин и некоторых видов рака у мужчин.
Источник
Статья посвящена приверженности режима лечения ВПЧ-ассоциированных заболеваний шейки матки
Введение
Мировые эпидемиологические обзоры свидетельствуют о том, что рак шейки матки занимает 2-е место по распространенности среди онкологических заболеваний женских репродуктивных органов и постепенно «омолаживается». По данным ВОЗ, ежегодно в мире регистрируется около 500тыс. новых случаев рака шейки матки, из них по меньшей мере половина имеет летальный исход. Доказан тот факт, что ведущей причиной развития цервикальной карциномы является вирус папилломы человека (ВПЧ), при этом более 660 млн людей на планете являются носителями папилломавирусной инфекции (ПВИ) [1–5]. По данным современных исследований, частота инфицирования ВПЧ в возрастной группе 16–29 лет составляет 45–81%. Около 40 генотипов ВПЧ выявляются преимущественно в эпителии аногенитальной области. К счастью, у большинства людей благодаря формированию эффективного вирус-специфического иммунитета ВПЧ-индуцированные изменения носят транзиторный бессимптомный характер и чаще всего (до 90% случаев) разрешаются в течение 1,5–2-х лет. Однако у ряда пациентов вирус не элиминируется, а длительно сохраняется в тканях, что в итоге может приводить к патологической трансформации эпителия. Что касается женского полового тракта, то известно, что переходная зона (transformation zone, Т-зона) шейки матки наиболее уязвима для ВПЧ ввиду наибольшей чувствительности метапластического эпителия к различным повреждениям, включая воздействие вирусной инфекции. Этим объясняются тропность ВПЧ к цервикальному эпителию Т-зоны и повышенный риск канцерогенеза в данной области [6–9].
Геном вируса папилломы человека представляет собой двухспиральную, скрученную в кольцо ДНК. В клетках базального слоя, которые со временем становятся постоянным источником инфицирования других эпителиальных клеток, экспрессируется 8–10 белковых продуктов, контролирующих процессы репликации, транскрипции и клеточной трансформации. Важно отметить, что в ходе адаптации к изменяющимся условиям существования и связанных с этим эволюционных превращений ВПЧ выработал различные способы обхода иммунологического надзора со стороны макроорганизма (размножение в пределах эпителия без вирусемии и цитолиза, наличие локальной иммуносупрессии за счет вирусных белков), что в ряде случаев обусловливает тенденцию к хроническому рецидивирующему течению инфекции [10–12]. Размножение вируса и синтез капсидных белков изменяют клеточный цикл и приводят к атипии клетки в течение 3-х лет с возможным развитием последующей малигнизации [13–15]. В ходе опухолевой прогрессии индуцируется многостадийный процесс генетических и эпигенетических повреждений ткани в результате длительной активации экспрессии вирусных онкобелков.
К заболеваниям шейки матки, предшествующим инвазивной цервикальной карциноме, относят дисплазии эпителия, или цервикальные интраэпителиальные неоплазии (CIN). Для них характерен сбой процессов дифференцировки клеток вследствие пролиферации камбиальных элементов с последующим развитием атипии, утратой полярности и нарушением гистоструктуры. Выделяют 3 степени тяжести CIN (CIN I–III) в зависимости от выраженности и глубины повреждений в эпителиальных слоях. По данным ВОЗ, распространенность CIN I в 3 раза превышает распространенность CIN II–III [2, 5, 16, 17]. Вероятно, что риск появления более глубоких патологических изменений, которые могут быть зафиксированы при цитологическом скрининге, возрастает по мере персистенции ВПЧ высокого онкогенного риска. Согласно данным литературы, после инфицирования ВПЧ CIN II–III развивается уже через 3 года у 27% женщин. Что касается анализа исходов диспластических состояний, ассоциированных с ВПЧ, было показано, что при CIN I регрессия наблюдается в 57%, персистенция – в 32%, прогрессия – в 11% случаев [17, 18].
Развитию рака шейки матки предшествует достаточно длительный промежуток времени – около 10–15 лет, а кроме персистенции высокоонкогенного генотипа ВПЧ в интегрированной форме необходимо также наличие кофакторов канцерогенеза: сочетания нескольких генотипов вируса, высокой вирусной нагрузки, сопутствующих урогенитальных инфекций, снижения резистентности организма, курения, длительного приема гормональных препаратов, генетической предрасположенности и т. д. [2, 6, 13, 14, 19–26]. Иные авторы для ориентировочного предсказания относительно особенностей течения CIN предлагают использовать клинико-анамнестические данные и параметры ряда исследований [11, 13, 27–29], однако, по мнению ведущих исследователей, надежных методов прогнозирования течения CIN, которые бы определяли у конкретных больных возможность стойкой персистенции или прогрессии в более высокую степень дисплазии либо рак с указанием точного времени длительности процесса, в настоящее время не существует (Роговская С.И., 2012) [30].
С учетом вышеописанного становится очевидным, что важными профилактическими мероприятиями в отношении цервикальной карциномы являются своевременная диагностика и адекватное лечение фоновых доброкачественных и предраковых заболеваний шейки матки и коррекция сопутствующих патологических состояний [6, 7, 14, 19, 30–33]. При этом неверная тактика может способствовать прогрессированию инфекционного процесса, появлению различных осложнений, ятрогенных состояний, существенным материальным затратам и снижению качества жизни пациенток. Предложено большое количество методов лечения аномально измененного эпителия шейки матки, однако ни один из них не является универсальным и безупречным. В целом же тактика ведения пациенток с цервикальной патологией стала более щадящей, но при этом для клинициста важно не отступать от принципа необходимости и достаточности.
Обсуждая проблемы, связанные с начальными проявлениями дисплазии, следует отметить, что до сих пор алгоритм ведения пациенток с CIN I четко не определен. Поскольку CIN I характеризуется высоким уровнем спонтанной регрессии наряду с невысоким уровнем прогрессии, большинство авторов полагают, что в течение 1,5–2-х лет тактика может быть выжидательной, однако ведение пациенток требует регулярного динамического наблюдения с использованием цитологического скрининга и расширенной кольпоскопии. В подобной клинической ситуации с современных позиций целесообразным может стать использование иммуномодуляторов с противовирусной активностью, поскольку иммунный статус во многом определяет характер течения ПВИ. Иммуномодулирующие препараты призваны усиливать защитные механизмы, особенно это важно для пациентов с нарушениями иммунитета [4, 14, 32, 34]. Несмотря на кажущееся обилие иммуномодуляторов на отечественном рынке, в настоящее время выбор препаратов весьма ограничен из-за отсутствия у большинства из них убедительной доказательной базы. Учитывая данные факты, стоит обратить внимание на проверенные и хорошо зарекомендовавшие себя средства. В этом плане среди предлагаемых препаратов указанной группы отдельный интерес представляет инозина пранобекс (Изопринозин), который относится к наиболее изученным системным иммуномодуляторам, поэтому включен в Европейское руководство по лечению бородавок и кондилом и в Российский протокол ведения пациенток с ПВИ. Являясь синтетическим производным пурина, посредством связывания с рибосомой клетки и изменения ее стереохимического строения препарат способствует подавлению репликации ВПЧ в эпителиальных клетках и элиминации его из организма [7, 31, 34–38]. Как иммуномодулятор, инозина пранобекс регулирует функции иммунокомпетентных клеток и активность цитокинов. Его противовирусное действие реализуется в отношении множества известных вирусов, в т. ч. ВПЧ, за счет ингибирования вирусной РНК и нарушения репликации вируса.
Более активная лечебная тактика и показания к хирургическому вмешательству при CIN I имеют место в следующих ситуациях: неудовлетворительные результаты кольпоскопии, обширная зона поражения, персистенция CIN I более 18 мес., возраст пациентки старше 35 лет, отсутствие возможности или нежелание женщины регулярно посещать врача для динамического контроля. В подобных случаях лечение CIN I проводится с использованием методов аблации или эксцизии шейки матки (с учетом оправданности того или иного типа вмешательства).
Планируя алгоритм лечения и понимая, что вирус находится не только в аномальном эпителии, но и во внешне неизмененных тканях по периферии очага, оптимальным стоит считать комплексное лечение, включающее не только локальное деструктивное воздействие на патологически измененные ткани, но и медикаментозную противовирусную терапию [4, 6, 7, 9, 30, 32, 39, 40]. Ранее проведенные исследования ряда ведущих отечественных и мировых научных учреждений показали, что инозина пранобекс достоверно повышает эффективность лечения ВПЧ-ассоциированных заболеваний, в том числе CIN и даже рака шейки матки, уменьшая выраженность клинических проявлений, ускоряя реконвалесценцию, повышая резистентность организма [2–4, 7, 14, 35–38].
Обобщая клинический опыт, стоит признать, что основными проблемами в настоящее время являются несвоевременная и некачественная диагностика цервикальной патологии, отсутствие точных схем и однозначных рекомендаций для принятия решения о врачебной тактике, а также недостаточная приверженность пациенток к лечению [14].
Не секрет, что зачастую психологически пациентки настроены на быстрое излечение с помощью некой «волшебной таблетки», и необходимость длительного лечения при отсутствии явных болезненных симптомов существенно снижает мотивацию следовать всем предписаниям врача. Безусловно, что в контексте достижения приемлемого результата лечения и улучшения прогноза заболевания большая роль принадлежит самому доктору, его профессионализму и умению установить контакт с пациенткой для повышения ее готовности следовать рекомендованному лечению. Между тем нередко приходится сталкиваться с полным или частичным невыполнением врачебных назначений. Безусловно, не только коммуникативные навыки врача и его способность вызвать доверие, но и лекарственная форма, переносимость, доступность препарата и ряд других факторов оказывают влияние на поведение больной. Тем не менее лишь грамотному и внимательному доктору доступно должным образом мотивировать пациенток на осмысленное, ответственное выполнение оздоровительных мероприятий, иными словами, повысить комплаентность (от англ. compliance – соблюдение, согласие, выполнение правил) – добровольное и осознанное следование пациента предписанному ему режиму лечения. Высокая комплаентность достижима в ходе взаимодействия, сотрудничества врача и пациента, что можно считать требованием современности, партнерского подхода с адекватным разделением ответственности.
Целью нашего исследования стала сравнительная оценка эффективности лечения дисплазии легкой степени шейки матки на фоне ПВИ с учетом ближайших и отдаленных результатов и полноценности выполнения пациентками лечебных назначений.
Материал и методы
Нами были проанализированы результаты лечения 62 женщин с цервикальной интраэпителиальной неоплазией (CIN I), ассоциированной с ПВИ, и показаниями к деструкции шейки матки. Возраст пациенток составил 37,0±2,8 года.
Пациентки прошли стандартное обследование, включая расширенную кольпоскопию, ПАП-тест и/или жидкостную цитологию и морфологическое исследование биоптата шейки матки, ПЦР-диагностику (полимеразная цепная реакция) генитальных инфекций, в т. ч. генотипирование ВПЧ с вирусной нагрузкой в режиме real-time. С учетом данных обследования, при необходимости перед хирургическим вмешательством проводились санация влагалища и коррекция биоценоза.
В ходе лечения всем женщинам была назначена аргоноплазменная коагуляция шейки матки по общепринятой методике, а также рекомендована терапия Изопринозином в дозе 2 таблетки (1000 мг) 3 р./сут в течение 10 дней за 2 нед. до аблации и через 2 нед. после нее.
Аргоноплазменная аблация выполнялась при условии полной кольпоскопической визуализации зоны трансформации и отсутствия расхождения между данными проведенных обследований. Использовался поток аргоновой плазмы в режиме «Спрей» мощностью 38–40 Вт. Осложнений во время процедуры не возникло ни в одном случае. По окончании вмешательства пациентки были отпущены домой с соответствующими рекомендациями.
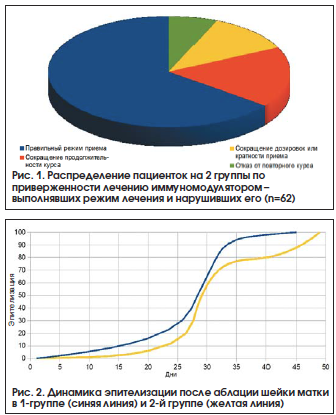
Путем подробного расспроса больных в процессе лечения и после него были выявлены пациентки, которые по различным причинам нарушили прием иммуномодулятора (часть из них произвольно сократили продолжительность курса, некоторые уменьшили дозировки и/или кратность приема, другие вообще отказались от повторного курса после хирургической процедуры). Таким образом, ретроспективно были сформированы 2 группы пациенток, которые в целом были сравнимы по возрасту, характеру менструального цикла, репродуктивному анамнезу: 1-ю группу составили 40 пациенток, которые прошли полноценное рекомендованное лечение, 2-ю группу – 22 больные, нарушившие режим приема Изопринозина (рис. 1).
Контрольный осмотр с расширенной кольпоскопией и определением вирусной нагрузки проводился через 1–1,5 мес. после операции и далее в динамике через 3, 6 и 12 мес. (включая также и цитологическое исследование).
Результаты
В процессе обследования пациенток с CIN во всех случаях были выявлены высокоонкогенные генотипы ВПЧ [16, 18, 31, 39, 45, 56, 59]. Сочетание ПВИ с другими клинически значимыми инфекциями гениталий имело место у 19,3% больных, включая бактериальный вагиноз, уреаплазмы, хламидии, вирусы герпеса.
Было установлено, что в 1-й группе (со строгим режимом приема иммуномодулятора) средняя продолжительность заживления шейки после процедуры составила 45,0±3,4 дня, что сопоставимо со скоростью эпителизации у женщин без ПВИ [40]. Во 2-й группе (с нарушенным режимом приема Изопринозина) имела место тенденция к замедленной регенерации цервикального эпителия (49,0±2,6 дня, р>0,5), что, по всей видимости, было обусловлено остаточным влиянием вирусной инфекции и неадекватной иммунной реакцией тканей (рис. 2).
Через 3 и 6 мес. в 1-й группе после комбинированного лечения у 97,5% пациенток, по данным цитологического и кольпоскопического исследований, атипичных изменений на шейке матки не выявлено. Прекращение вирусовыделения из очага отмечено уже в течение ближайших 2-х мес. в 92,5% случаев; у остальных пациенток после прогрессивного снижения вирусной нагрузки через 3, 6 и 12 мес. ДНК ВПЧ также не определялась.
У единственной пациентки с носительством 3-х высокоонкогенных генотипов ВПЧ и исходно высоким уровнем вирусной нагрузки (6,8 Lg) через 3 мес. выявлен рецидив CIN. Помимо указанных отягощающих факторов, мы связываем трудности лечения и подобный исход в данной ситуации с существенными расстройствами в дифференцировке клеточных пластов и дистрофическими изменениями эпителия на фоне длительного гормонального дисбаланса (гипогонадотропная аменорея).
Во 2-й группе клиническая эффективность лечения дисплазии шейки матки составила 86,4%, при этом прекращение вирусовыделения из очага в течение 3–6 мес. было достигнуто лишь в 63,6% наблюдений, у остальных больных наблюдалось снижение вирусной нагрузки до 3–5 Lg. Свидетельством персистенции и реактивации вирусной инфекции стали рецидивы атипии в тканях в виде появления ASCUS и LSIL (по The Bethesda System), мозаики, пунктации, признаков гиперкератоза и йод-негативных зон по результатам контрольных исследований. Подобные изменения в данной группе зафиксированы в течение 3–6 мес. у 3-х пациенток (13,6%, р<0,05).
Что касается побочных эффектов в процессе приема Изопринозина, то они наблюдались лишь у 3-х пациенток из 62 обследованных, что составило 4,8%. Среди жалоб эпизодически отмечались тошнота, дискомфорт в эпигастрии, аллергические реакции в виде кожной сыпи. В ходе опроса пациенток установить связь нарушений предписанного режима приема Изопринозина с указанными побочными эффектами не удалось, они не стали поводом для отмены или отказа пациентки от приема и самостоятельно нивелировались через несколько дней. Этот факт можно считать свидетельством хорошей переносимости и высокого профиля безопасности препарата. В качестве же основных причин нарушений приема иммуномодулятора пациентками были отмечены: недопонимание важности продолжения медикаментозной терапии, забывчивость и отсутствие должного самоконтроля на фоне низкой мотивации, финансовые трудности.
Обсуждение результатов
Локальная деструкция очагов CIN позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, тогда как в окружающих тканях сохраняются резервуары ВПЧ в латентном состоянии, которые могут стать основой для рецидива дисплазии. Известно, что уровень остаточных поражений и рецидивов после лечения CIN составляет 5–15%, причем чаще всего они отмечаются в течение первых 2-х послеоперационных лет [2]. Если учесть, что во всех случаях у обследованных нами пациенток в качестве этиологических факторов имели место высокоонкогенные генотипы ВПЧ, то длительная стойкая персистенция вирусной инфекции могла быть ассоциирована с высокой вероятностью развития более тяжелых степеней дисплазии и дальнейшей малигнизации. В связи с этим обоснованно предположение, что адекватная иммунотерапия наряду с аблацией шейки матки способствует полноценной санации инфекционного очага и эпителизации, что закономерно снижает частоту рецидивов и прогрессирования заболевания.
Выводы и заключение
Таким образом, результаты проведенного исследования свидетельствуют о высокой эффективности и безопасности сочетания аблативного вмешательства и иммуномодулирующей терапии Изопринозином при условии соблюдения рекомендованных схем лечения. Комбинированное использование методик деструкции и инозина пранобекса способствует удлинению межрецидивного периода, прекращению вирусовыделения, в т. ч. при наличии нескольких генотипов ВПЧ. Таким образом, подобную комплексную терапию CIN на современном этапе можно рассматривать как одну из наиболее эффективных, что согласуется с данными литературы [3, 4].
Не вызывает сомнения, что по отношению к пациенткам, инфицированных ВПЧ, особенно типами высокого онкогенного риска, должна применяться наиболее активная диагностическая и лечебная тактика. Больные должны строго выполнять назначения врача. Соблюдение этих условий позволит ожидать полноценной реализации лечебного действия. В связи с этим к числу основных задач врача относятся информирование и создание должной мотивации пациенток, что будет залогом формирования приверженности лечению и его успешности.
Статья подготовлена при поддержке компании ООО «Тева».
За дополнительной информацией обращаться:
OOO «Тева» Россия, 115054, г. Москва, ул. Валовая, д. 35
Тел.: + 7 (495) 644-22-34,
факс + 7 (495) 644-22-35,
www.teva.ru
ISPR-RU-00265-DOK
Источник

